ASİTLER , BAZLAR VE TUZLAR
Asitlerin Genel Özellikleri
Siyah üzüm → Tartarik Asit
Limon → Sitrik Asit
Elma → Malik Asit
Sirke → Asetik Asit
Portakal Mandalina → Askorbik Asit
Yoğurt → Laktik Asit
Aspirin → Asetil salisilik Asit
Karınca Salgısı→Formik asit
Tereyağı→Bütirik asit
Bazların Genel Özellikleri
Sabun → C17H35COONa Deterjan → C12H25OSO3Na
Çamaşır Suyu → NaCIO Çamaşır Sodası → Na2CO3
Sönmüş Kireç → Ca (OH)2 Kireç Taşı → CaCO3
Lavabo Açıcı → NaOH (sudkostik) → KOH (potaskostik)
Yemek Sodası → NaHCO3 Cam Temizleme Suyu → NH3
Bozuk Balık, Pis Kokular → (CH3)3N (trimetilamin)
ASİTLER VE BAZLARDA pH ve pOH KAVRAMI
pH → [OH+] iyon derişimi gücünü gösterir.
pOH → [OH-] iyon derişim gücünü gösterir.
pH + pOH= 14
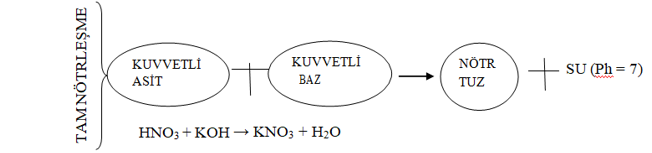
H+ + [OH+] → Ph = 7 Nötr Çözelti
H+ > [OH+] → Ph < 7 Asidik Çözelti
H+ < [OH+] → Ph > 7 Bazik Çözelti

ASİTLERİN KUVVETLİLİĞİ
KUVVETLİ ASİTLER
H2SO4
HNO3
HCI
ZAYIF ASİTLER
CH3COOH
HCOOH
HF → Cam asidi
H2CO3 → Kola asidi HCN
HNO2
H3PO4
BAZLARIN KUVVETLİLİĞİ
KUVVETLİ BAZLAR
NaOH
KOH
LiOH
Mg(OH)2
ZAYIF BAZLAR
NH3: Amonyak
C6H5NH2: Anilin
İNORGANİK ASİTLER (SUDA ÇÖZÜNME DENKLEMLERİ)
HNO3 (s) →…………………………..→Nitrik Asit (Kezzap)
H2SO4 (s) → …………………………→Sülfürik Asit (Zaç Yağı)
HCI (s)→ …………………………..→Hidroklorik Asit (Tuz Ruhu)
H3PO4 (s) →…………………………..-->Fosforik Asit
H2CO3 (s) → ………………………..→Karbonik Asit
HNO2 (s) →……………………………..-->Nitröz Asit
HCN (s)→…………………………… →Hidrosiyanik Asit
HCIO→……………………………-->Hipokloröz Asit
ORGANİK ASİTLERİN SUDA ÇÖZÜNMELERİ
CH3 COOH → ……………………………………..
Asetik Asit
Sirke Asidi
Etanoik Asit
HCOOH → …………………………………..
Formik Asit
Metanoik Asit
ASİTLERİN TESİR DEĞERLİĞİ → Ortama verdikleri H+ sayısıdır.
HCL 1
H2SO4 2
H3PO4 3
CH3COOH 1
BAZLAR SUDA ÇÖZÜNME DENKLEMLERİ
NaOH (k) → …………………………………..
KOH (k) → …………………………………..
Ca(OH)2 (k) → ………………………………..
NH3 + H2O →…………………………………
UYARI: Yapısında H olmasına rağmen baz karakterli?
BAZLARIN TESİR DEĞERLİĞİ: Ortama verdikleri OH- sayısıdır.
BİLEŞİK |
+d |
NaOH |
1 |
Mg(OH)2 |
2 |
Al(OH)3 |
3 |
NH3 |
1 |
C6H5NH2 |
1 |
ASİDİK OKSİT
Örnek: CO2 – SO2 – SO3 – NO2 – N2O5→ Asidik oksitler
Örnek:
BAZ İLE
CO2 + 2NaOH → ……….. + H2O
SU İLE
CO2 (g) + H2O (s) → ……….. (suda) (Karbonik Asit, Gazlı İçecek)
SO2 (g) + H2O (s) → …………. (suda) (Sülfüröz Asit)
SO3 (g) + H2O (s) →………….. (suda) (Sülfürik Asit)
N2O5 (g) + H2O (s) →…………… (suda) (Nitrik Asit)
3NO2+ H2O (s) → …………… (suda) + NO (g)
CO2, SO2, N2O5 → Asit arihidritide denir.
BAZİK OKSİT
Örnek: Na2O, Li2O, MgO, CaO …..
ASİTLE
Na2O + 2HCI → ………..…………+ H2O
CaO + H2SO4 → ………………….. + H2O
Fe2O3 + HCI → ………….. + 3H2O (s) (Pas ve tuz ruhu )
BAZLA
CaO + H2O → ………………. + ısı
Sönmemiş Kireç Sönmüş Kireç
Na2O + H2O → ………………….
NÖTR OKSİT
AMFOTER OKSİT
ASİT İLE BAZLA
ZnO + 2HCI → ZnCI2 + H2O
Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
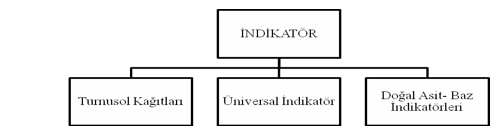
İNDİKATÖRLER
İndikatörler: zayıf asit veya baz özelliği gösteren renkli maddeler olup, renkleri ortamın pH’ına göre değişiklik gösteren organik boyalardır.
İndikatör |
Asit Rengi |
Baz Rengi |
Metil Oranj |
Kırmızı |
Sarı |
Turnusol |
Kırmızı |
Mavi |
Fenolftalein |
Renksiz |
Kırmızı |
Alizarın Sarısı |
Sarı |
Eflatun |
Metil Sarısı |
Kırmızı |
Sarı |
Brom Krezol Yeşili |
Sarı |
Mavi |
Nötral Kırmızısı |
Kırmızı |
Sarı |
B. DOĞAL ASİT- BAZ İNDİKATÖRÜ
Böğürtlen- kiraz- kırmızı lahana- yaban mersini- lale- gelincik- üzüm.
Örnek: Kırmızı Lahana Suyu
pH = 1-2 Kırmızı
pH = 7 Lavanta
pH = 12 Yeşil renk
Çilek suyu
Asidik ortamda: pembe
Bazik ortamda: açık yeşil renk verir.
Tekli şeritlerin üzerine özel kağıtlardan yapılmış organik boyar maddelerle renklendirilmiş.
ASİTLER , BAZLAR VE TUZLAR
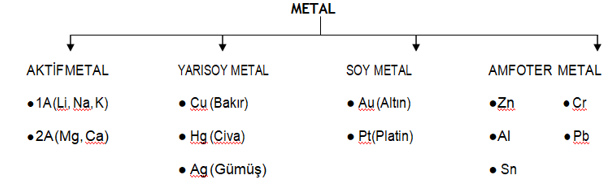
1 - ASİT + AKTİF METAL → TUZ + H2(g)
Oksijensiz Asit + Yarısoy metal → Tepkime yok
Oksijenli Asit+ Yarısoy Metal → TUZ + GAZ + H2O
SOY METAL + ASİT → Tepkime yok
NOT: Au ve Pt sadece Kral suyu ile tepkime verir.
Au (k) + 3HCI+ HNO3 → AuCI3 (suda) + NO (g) + 2H2O (g)

Zn: Çinko Cr: Krom Sn: Kalay Pb: Kurşun Al: Alüminyum
KARBONATLI BİLEŞİK + ASİT → TUZ + SU+ CO2 (g)
ASİT- BAZ TEPKİMELERİ (TUZLAR)
Kimyasal Tepkimelerde
Atomları cinsi-sayısı
Toplam Kütle -------> KORUNUR
Toplam Yük
Toplam Mol -------> KORUNMAYABİLİR
Toplam Hacim
NÖTRLEŞME: ASİT + BAZ → TUZ + SU
Doğadan, kaya tuzlarından deniz suyu tuzlu göl sularının buharlaştırılmasından elde edilir.
UYARI: HCI(g) + NH3(g)→ NH4CI + ISI
Asit Baz Tuz