1913-BOHR ATOM MODELİ
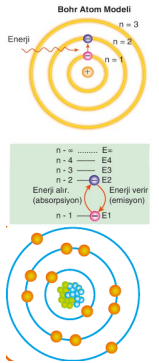
1913 yılında Niels Bohr, hidrojenin ışıma spektrumuna dayanarak ve Planck'ın kuantum kuramını göz önüne alarak yeni bir atom modeli önermiştir. Hidrojen atomunun kesikli spektrum çizgileri oluşturmasından hareketle atomdaki elektronların kuantlaşmış enerjilere sahip olabileceğini düşündü.
Bohr atom modeline göre;
Bohr, hidrojen atomunun enerji düzeyleri arasında elektronun geçişleri neticesinde yayılan ışımaların frekanslarını hesaplayacak bir formül oluşturmuştur.
v = 3,289.1015 . (1/n2i - 1/n2d) (ni = iç , nd = dış)
Hidrojen atomundaki bir elektronun enerji düzeyleri arasındaki geçişlerde soğurulan veya yayınlanan enerji her bir enerji düzeyinin sahip olduğu enerji arasındaki fark hesaplanarak bulunabilir. Ayrıca ΔE = h.ν eşitliğinde, hidrojen için oluşturulan frekans (ν) eşitliği yerine yazılırsa;
ΔE = 6,626.10-34 . 3,289.1015.(1/n2i - 1/n2d)
ΔE = 2,18. 10-18 . |(1/n2i - 1/n2d)|
denklemi ile yayınlanan veya soğurulan ışının enerjisi hesaplanabilir.
Enerji Serileri

Hidrojen atomu uyarıldığında, uyarılan elektron daha düşük enerjili düzeylere indiğinde çeşitli dalga boylarında ışınlar yayar. Bu ışın serileri aşağıdaki gibi özetlenebilir.
Bu iyonlar için çekirdek yükünün etkisi de dikkate alınarak: En = 2.18.10-18 . Z2 / n2 denklemine göre enerji düzeylerindeki elektronların enerjisi bulunabilir. Bağıntıdaki ''Z'' atom numarasını, ''n'' ise enerji seviyesi numarasını göstermektedir.
1914- Moseley : Çekirdek yüklü protonlardan kaynaklanır.
Rutherford çekirdekteki proton sayısını yani çekirdek yükünü tayin edememişti.
Moseley katot ışınları tüpünde anot olarak farklı elementler kullandı.Her elementin farklı dalga boyunda x ışını yaydığını gözledi.
Yayılan x ışınlarının atomun çekirek yüküne bağlı olduğunu bununda protonlardan kaynaklandığını söyledi.
Yapılan çalışmalar sonucu her elementin çekirdek yükünün proton sayısına eşit olduğu görüldü.
Moseley yaptığı deneylerde;
PROTON: Moseley, X-ışınları tayflarına dayanarak, atom numaralarını doğru olarak hesaplamayı başarmıştır.
Moseleyin deneyi yukarıda açık biçimde verilmiştir.
Moseley, atomun çekirdeğinde bulunan bu + yüklü taneciklere proton adını vermiştir.
Atom numarası olarak bilinir.
Çekirdek yükünü belirler.
Atoma kimyasal özelliğini kazandıran taneciklerdir.
Nötr atomlarda proton sayısına eşittir.
Atom numarası(z)=çekirdek yükü=proton sayısı → Nötr bir atomda àproton sayısı=elektron sayısı → iyon yükü=proton sayısı-elektron sayısı x → X+2 (2 e vermiştir)
X → X+n +ne- endotermiktir, elektron başına düşen ortalama çekim kuvveti artar, olay sırasında çekirdeğin çekim gücü değişmez, tanecik hacmi azalır.
1924-De Broglie → Elektronun ikili doğası
De Broglie elektron gibi atom altı parçacıkların bazen dalga özelliği taşıdığını ileri sürdü E = h.c/λ E=m. C2 bu iki eşitlik birleştirildi. h.c/λ = m. C2 → λ = h/m.V V→ ışık hızı
Bu denklem hareket halindeki bir taneciğin dalga gibi, dalganında tanecik gibi düşünülebileceğini ifade eder.
1925-Davison ve Germer → Elektron kırılımı deseni
İnce bir nikel levha üzerine elektron demeti gönderdiklerinde X ışınları ile elde edilene benzer iç içe halkalar gördüler. Böylece elektronların dalga özelliğine sahip olduğu kanıtlandı.
1925-Pauli → Dışlama ilkesi
1920’li yıllarda plank’ın kuantum yaklaşımlarından bazı çıkarsamalar yapıldı çekirdeğin çevresindeki elektronların orbital denilen bir olasılık bulutu içerisinde hareket ettiği söylendi. Paulide bu düşünceleri geliştirerek bir orbitalde birbirine zıt spinli en çok iki elektron bulunabileceğini söyledi. Pauli ilkesine ilerde tekrar değinilecektir.
1926- Scrhödinger → Atom dalga modeli → Modern atom teorisi
Scrhödinger geliştirdiği denklemle elektronun tanecik ve dalga davranışını inceledi. Kendinden önceki düşünceleri harmanlayarak atomun dalga Mekaniğini ortaya attı. Denklem hidrojen atomundaki elektronun tam yerini belirleyemezken elektronun nerede olduğunu açıklıyordu. Böylece orbital kavramı gelişti.
Orbital kavramıyla elektronların yerinin belirlendiği denklemle artık atomla ilgili birçok perde ortadan kalkmış ve soyut kavramlarda olsa atom açıklanabilmiştir. İnsanoğlunun kendini zamanla geliştirdiğini zaman içerisinde görmekteyiz. Bu gelişme hiç durmadan devam edecek ve daha bilinmeyen bir çok şey açıklanmaya devam edecektir.
ORBİTAL KAVRAMI
n,l ve ml kuantum sayıları hidrojen atomu için Scrhödinger denkleminin çözümünden ortaya çıkmıştır. Bir elektronun dalga fonksiyonu bir orbitali tanımlar. Shrödinger elektronların yerlerini tesbit edebiliyor, elektronların yoğun olarak bulundukları bölgelere orbital dedi.Yani elektronun bulunma olasılığının yüksek olduğu yerlere orbital denir. Ve bu orbitallar bildiğiniz gibi yörüngelerde bulunur. s,p,d,f gibi orbital çeşitleri vardır. Bu bulunma olasılığı shrödinger denkleminde ψ2 olarak simgelendirilmiştir.
1927- Heisenberg belirsizlik ilkesi
Scrhödinger dalga mekaniğinden yararlanarak belirsizlik ilkesini önerdi. Bir elektronun konumu belirlenirse hızının, Hızının belirlenirse konumunun belirlenemeyeceğini söyledi.
Konumu için verilen enerji elektronun hızını, hızını belirlemek için verilen enerji konumunu değiştirecek ve bir belirsizlik doğacaktı.
1932- James Chadwich → Nötronların keşfi
İnce berilyum levha üzerine α ışınları gönderildi. Berilyum metalinin çok yüksek enerjili elektirik yükü taşımayan ve kütlesi protonun kütlesinden biraz daha büyük olan ışınlar yaydığını gördü. Bunlara nötron adı verdi.
Kütle Numarası(a)=Proton sayısı +Nötron sayısı şimdi bizi ilgilendiren atomla ilgili bazı kuantum ifadelerini inceleyelim.
Kuantum Sayıları
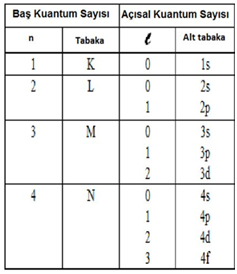
Kuantum sayıları, atomdaki her bir elektronun hangi enerji düzeyinde bulunduğunu belirlemek için kullanılan sayılardır. Bunlar,
Baş kuantum sayısı (n)
Açısal momentum (ikincil) kuantum sayısı (l )
Manyetik kuantum sayısı (ml ) dır. Bu üç kuantum sayısı elektronların bulunma olasılığının en yüksek olduğu yerlerin ve bu yerlerdeki elektronların belirlenmesinde kullanılırken diğer bir kuantum sayısı,
Spin kuantum sayısı (ms) ise elektronun davranışını belirlemede kullanılır.