Bileşik Formüllerinin yazılması:

İYONİK BİLEŞİKLERİN ADLANDIRILMASI
a) Kural : METAL ADI + AMETAL ADI (7A GRUBU) + ÜR à BİLEŞİĞİN ADI
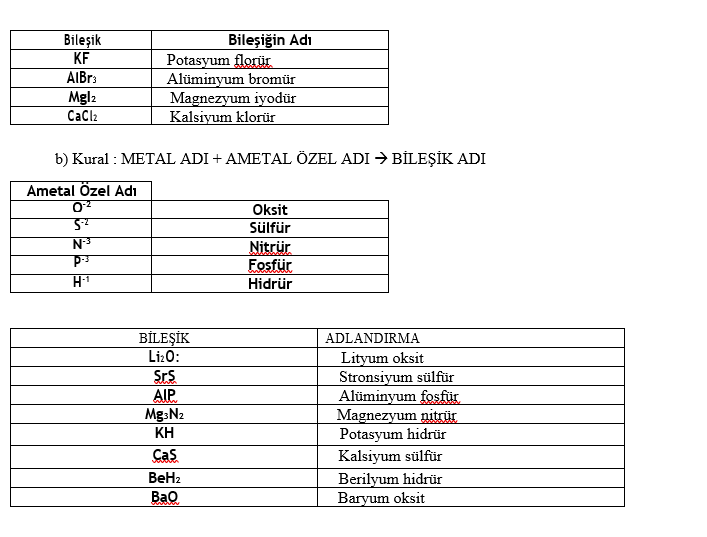
c) Kural : METAL ADI + KÖK ADI à BİLEŞİK ADI

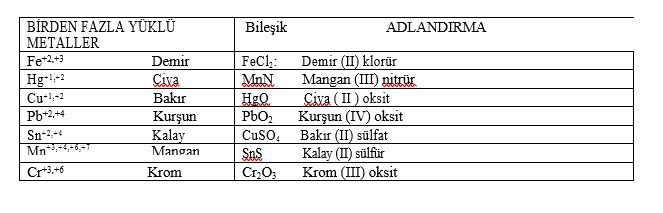
2. Metal Birden Fazla Değerlik Alan Bir Metal ise ; Kural: METAL ADI + ROMA RAKAMI İLE YÜKÜ + AMETAL ÖZEL ADI (AMETAL ADI+ÜR)à BİLEŞİK
2.KOVALENT BAĞ
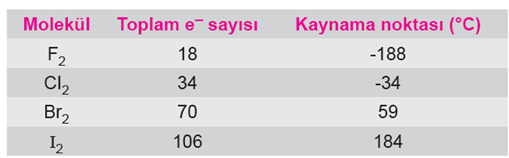
F2 → gaz Br2 → sıvı I2 → katı
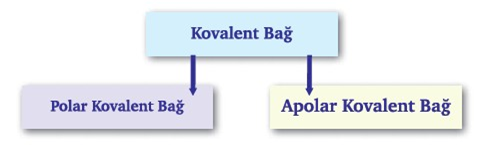

KURAL:
1.AMETALİN LATİNCE SAYISI + 1. AMETAL ADI + 2.AMETALİN LATİNCE SAYISI + 2.AMETAL ADI
Latince Sayılar
Mono:1
Hekza:6
NOT: 1.Ametalden bir tane varsa MONO kullanılmaz
Di:2
Hepta:7
NOT: Bileşikte metal varsa Mono, di diye okunmaz
Tri:3
Okta:8
NOT: Bileşiklerinde belli sayıda su molekülü bulunan
Tetra:4
Nona:9
bileşiklere HİDRAT denir.
Penta:5
Deka:10
CuSO4.5H2O = Bakır(II) Sülfat penta hidrat
Mg(NO3)2.7H2O= Magnezyum nitrat hepta hidrat
METALİK BAĞLAR
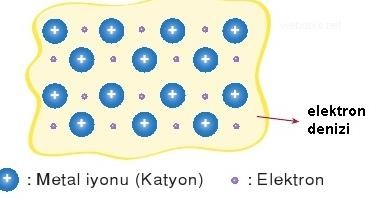
METALLERİN ÖZELLİKLERİ METALİK BAĞ İLİŞKİSİ
1.TEL VE LEVHA HALİNE GETİRİLME
Metallere çekiçle vurulduğunda metal atomları elektron denizinde kayar.

2. METALLERİN ELEKTRİK İLETKENLİĞİ
3.METALİK PARLAKLIK
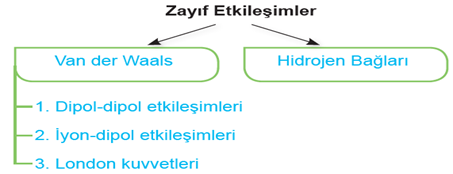
ZAYIF ETKİLEŞİMLER

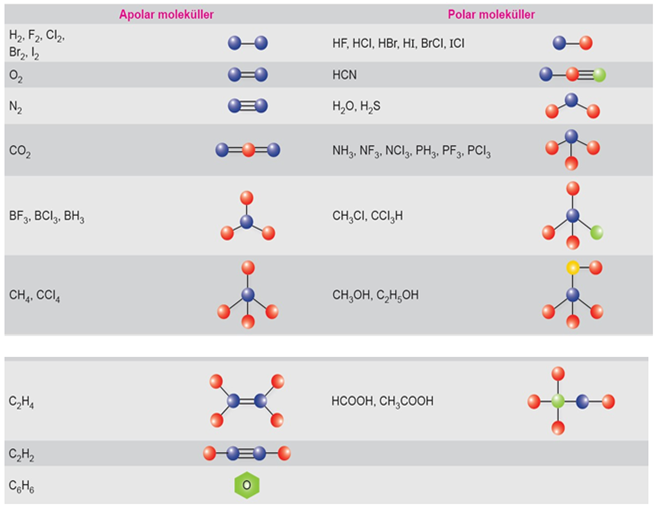
Polar moleküllerin birbirine yakınlaşması ile zıt uçlar birbirini çekerken, aynı yüklü kısımlar birbirini iter.
Polar yapıya sahip tüm kovalent bağlı moleküllerde dipol-dipol etkileşimi bulunur.
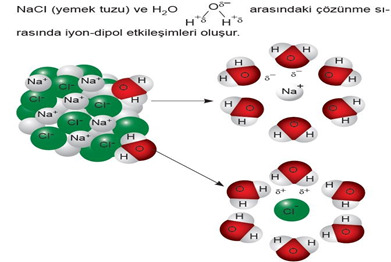
İyonik katıların su gibi polar çözücülerde çözünmesini sağlayan etkileşim iyon-dipol çekim kuvvetleridir.
Tüm iyonik bağlı bileşiklerin polar moleküller ile etkileşiminde iyon-dipol kuvvetleri bulunur.
İyon ile polar molekülün zıt yüklü uçları arasındaki elektrostatik çekim kuvvetine iyon-dipol etkileşimleri denir.
C. London Kuvvetleri
Apolar moleküller ve asal gaz atomları arasında oluşan çekim kuvvetleridir. Apolar moleküllerdeki tanecikler üzerinde sürekli pozitif veya sürekli negatif olan belirli bir kısım yoktur.
London kuvvetleri
– Elektron sayısı arttıkça
– molekül / atom kütlesi arttıkça
– molekül üzerindeki temas yüzeyi arttıkça artar.
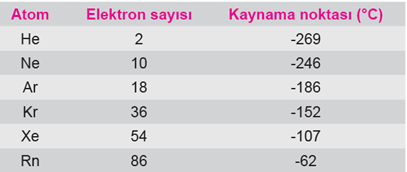
Örneğin soygazlarda 2He, 10Ne, 18Ar, 36Kr, 54Xe, 86Rn atom numarası yeni elektron sayısı arttıkça anlık polarlanma artacağından grupta aşağı doğru inerken atomun erime ve kaynama noktası artar.