SİSTEMLERDE ENTALPİ DEĞİŞİMİ :
ENTALPİ (H) VE ENTALPİ DEĞİŞİMİ
Sabit hacimli bir sisteme verilen ısı (Qv) sistemde iş yapamadığından dolayı sistemin sıcaklığını yükseltirken sadece iç enerjinin artışında kullanılmıştır. Qv = ΔU Sabit basınçlı sisteme verilen ısı (Qp) sistemin sıcaklığını yükseltirken, sistemde hacim değişikliğine sebep olmuştur. Bu durumda iç enerjideki değişim yanında yapılan mekanik işinde içinde bulunduğu H = U + w bağıntısı geçerli olur.
Bu sisteme dışarıdan enerji verildiğinde +Qp yani ΔH > 0, sistemden ısı şeklinde enerji kaybı olursa –Qp yani ΔH < 0 olur. Bir kimyasal reaksiyondaki entalpi değişimi reaksiyon entalpisi (ΔH) olarak tanımlanır. Reaksiyonda oluşan ürünlerin entalpileri ile reaksiyona girenlerin entalpileri arasındaki farka eşittir. Bu durum ΔH = H (ürünler) – H (girenler) şeklinde gösterilir.
Reaksiyon Entalpisinin (ΔH) Değerini Etkileyen Faktörler
Sıcaklık ve basınç koşullarına bağlıdır. Entalpi değeri 25°C ve 1 atmosfer basınç koşullarında hesaplandığından bu koşullar değiştiğinde ΔH değeri değişir. Maddelerin fiziksel halleri değiştiğinde tepkimenin ΔH değerleri değişir.
H2(g) + 1/2 O2(g) → H2O(g) + Q1
H2(g) + 1/2 O2(g) → H2O(s) + Q2 tepkimelerinde açığa çıkan ısı değeri farklıdır.
Maddelerin farklı fiziksel hallerinin entalpileri arasında Hgaz > Hsıvı > Hkatı ilişkisinin var olduğunu bilmek tepkime entalpilerini karşılaştırmada kolaylık sağlayacaktır. Madde miktarı değiştiğinde tepkimenin ΔH° değeri değişir. Bir tepkimede mol sayısı ile ΔH° değeri doğru orantılıdır.
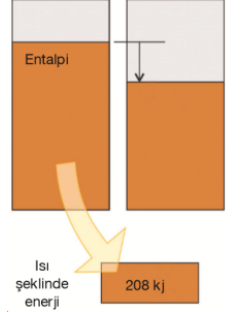
Bir sistemin entalpisi bir kaptaki suyun yüksekliğinin ölçüsü gibidir. Isı veren bir tepkime sabit basınçta 208 kj ısı saldığında ''kaptaki su'' yüksekliği 208 kj düşer ve ΔH = –208 kj olur.
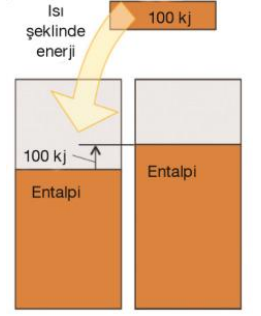
Isı alan bir tepkime sabit basınçta 100 kj'lük ısı soğurursa entalpi ''kabının'' yüksekliği 100 kj artar ve ΔH = +100 kj olur.
CaO(k) + H2O(s) → Ca(OH)2(k)
ΔH° = –64 kj 1 mol CaO ile 64 kj ısı açığa çıkıyorsa
2 mol CaO ile ?
? = 128 kj ısı açığa çıkar.
1. Endotermik (Isı Alan) Tepkimeler
Bir kimyasal reaksiyonda tepkimeye giren maddelerin entalpileri toplamı, ürünlerin entalpileri toplamından küçük olduğu durumdur. Endotermik bir dönüşüm gerçekleşme süreci boyunca dışarıdan ısı almaya devam eder. Dolayısıyla endotermik reaksiyonlar kendiliğinden gerçekleşmez ve reaksiyon entalpisinin (ΔH) işareti “+” dır.
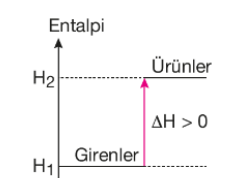
H1 = Girenlerin entalpileri toplamı
H2 = Ürünlerin entalpileri toplamı
H2 - H1 = Tepkime entalpisi (ΔH)
Buharlaşma H2O(s) → H2O(g)
Erime Fe(k) → Fe(s)
Ayrışma (Analiz) tepkimeleri CaCO3(k) → CaO(k) + CO2(g)
Ametallerin 2. ve daha sonraki elektron ilgileri O- + e- (g) → O2-(g)
Birçok katı ve sıvının suda çözünmesi C6H12O6(k) → C6H12O6(suda)
Süblimleşme I2(k) → I2(g)
Elektroliz H2O(s) → H2(g) + 1/2 O2(g)
Atomların 1. iyonlaşma enerjileri Na(g) → Na+(g) + e-
Azotun yanması N2(g) + 1/2 O2(g) → N2O(g)
Bağ kırılması H2 → H + H olayları endotermiktir.
Endotermik reaksiyonlarda ΔH > 0’dır.
Bu tür reaksiyon denklemleri X + Y + ısı → Z
X + Y + Q kj → Z
X + Y → Z ΔH > 0 şeklindedir. Endotermik reaksiyonlarda girenler, ürünlerden kararlıdır.
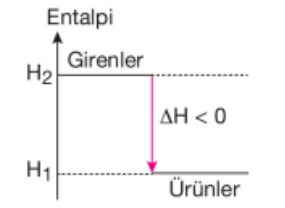
2. Ekzotermik (Isı Veren) Tepkimeler
Bir kimyasal reaksiyonda ürünlerin entalpileri toplamının girenlerin entalpileri toplamından küçük olduğu durumdur.
X + Y →Z + ısı
X + Y →Z + Q kj
X + Y →Z ΔH < 0
Donma (H2O(s) → H2O(k)) Kırağılaşma (X(g) → X(k) )
Yoğuşma (H2O(g) → H2O(s) )
Nötürleşme (HNO3(suda) + KOH(suda) → KNO3(suda) + H2O(s) )
Yanma olayları (N2’nin yanması hariç) (C(k) + O2(g) → CO2(g) )
Bütün gazların suda çözünmesi(N2O(g) + su → N2O(suda))
Elementlerin 1.elektron ilgileri (F(g) + e- → F-(g) )
Bağ oluşumu (H(k) + Br(k) → HBr(g) )
Birçok sentez (birleşme) tepkimeleri (MgO(k) + SO3(g) → MgSO4(k) )
Pil tepkimeleri (Zn(k) + Fe2+(suda) → Zn2+(suda) + Fe(k) ) olayları ekzotermiktir.
STANDART OLUŞUM ENTALPİLERİ :
Entalpi, iç enerjiye bağımlı bir özelliktir ve entalpide bir hal fonksiyonu olduğundan ancak entalpi değişiminin (ΔH) belirli bir değeri vardır. Bir maddenin ΔH değeri doğrudan elementlerinden sentezlenen tepkimeler üzerinden belirlenir. Bir bileşiğin elementlerinden oluşması sırasındaki entalpi değişimine oluşum entalpisi (oluşum ısısı) denir ve ΔHf şeklinde gösterilir. Elementlerin ise en kararlı doğal hallerindeki standart oluşum entalpileri sıfır kabul edilir.
Örneğin, Na(k) , Fe(k) , N2(g) , O2(g) , H2(g) , C(k) , Cu(k) maddelerinin standart koşullarda oluşum entalpileri sıfırken, Cu(s) , H(g) , Fe(s) , O(g) maddelerinin oluşum entalpileri sıfırdan farklıdır. Ayrıca standart şartlarda birden fazla allotropu olan elementlerin oluşum entalpileri değerleri için en kararlı allotropları esas alınır. O2 ve O3 allotroplarından standart koşullarda daha kararlı olan O2 gazıdır. Bu nedenle O2 gazının oluşum entalpisi sıfır alınır.
Maddelerin oluşum entalpileri;
Sıcaklığa ve basınca
Maddelerin fiziksel haline (katı, sıvı, gaz) bağlıdır.
Bir bileşiğin 1 molünün standart şartlarda (1 atm ve 25 °C) elementlerinden oluşması sırasındaki entalpi değişimine standart oluşum entalpisi denir ve ΔH°f ile gösterilir.
C(k) + 2H2(g) → CH4(g) ΔH°f = –75 kj
N2(g) + 1/2O2(g) → N2O(g) ΔH°f = +9 kj
Oluşum entalpisi, endotermik veya ekzotermik olabilir.
Mol başına yapılan isimlendirmede entalpinin başına molar kelimesi eklenir. Bir bileşiğin 1 molünün elementlerinden oluşmasına ilişkin tepkimenin entalpisi de o bileşiğin molar oluşum entalpisi olarak tanımlanır. Mol başına yapılan isimlendirmede entalpinin başına molar kelimesi eklenir. Bir bileşiğin 1 molünün elementlerinden oluşmasına ilişkin tepkimenin entalpisi de o bileşiğin molar oluşum entalpisi olarak tanımlanır.
Bir tepkimenin entalpi değişimi, ürünlerin standart oluşum entalpileri toplamından girenlerinstandart oluşum entalpileri toplamı çıkarılarak bulunabilir.
ΔH° = ΣnΔH°f (ürünler) – ΣnΔH°f (girenler)