KİMYASAL TEPKİMELER
Mol Kavramı:
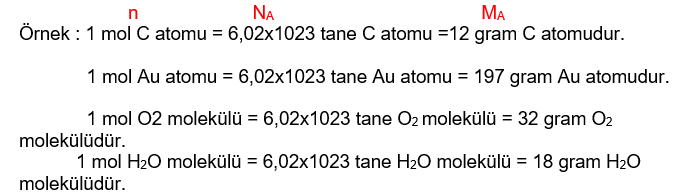
Bilim insanları atom, molekül gibi çok küçük kimyasal türleri ölçmek ve gerekli hesaplamaları yapmak için mol adı verilen bir kavram geliştirmişlerdir. Mol ‘ n’ ile gösterilir. 1 mol 6,02x1023 sayısına karşılık gelir. Mol kavramı sayesinde sayılamayacak büyüklükteki kavramlar sayılabilecek birimlerle ifade edilmiş olur. Nasıl ki bir düzine, 12 sayısına; bir deste, 10 sayısına karşılık geliyorsa 1 mol de 6,02x1023 sayısına karşılık gelir. Avagadro sayısı olarak adlandırılır. ‘NA ‘ ile gösterilir. 1 mol (6,02×1023 tane) maddenin gram cinsinden kütlesine mol kütlesi veya mol ağırlığı denir. Birimi g/mol’dür. ‘ MA’ ile gösterilir.
Bağıl Atom Kütlesi :
Günümüzde bütün atomların kütleleri standart kabul edilen karbon-12 izotopunun kütlesine göre belirlenir. Bir atomun kütlesi karbon-12 izotopunun kütlesi ile karşılaştırılarak hesaplanır.
Bir atom kütlesinin karbon kütlesine kıyaslanması ile bulunan sayıya bağıl atom kütlesi (ağırlığı) denir.
Örnek : 28Siʼun kütlesi 27,98; 56Feʼin kütlesi 55,93; 107Agʼün kütlesi 106,90509 olarak bulunur. Bu sayılar yerine genellikle sayıların yaklaşık değerleri kullanılır.
Atomik Kütle Birimi :
Bir tane karbon-12 atomunun kütlesinin on ikide birine 1 atomik kütle birimi (akb) denir. Atomik kütle birimi; gram, kilogram gibi bir kütle ölçüm birimidir. Aşağıdaki şekilde grama çevrilebilir.
Örnek :

İzotop Atomlar ve Ortalama Atom Kütlesi
Bilim insanları uzunca bir süre Dalton Atom Modeliʼnin önerdiği gibi aynı element atomlarının özdeş olduğuna inanmışlardır. Ancak kütle spektrometresinin bulunmasıyla aynı elemente ait farklı kütleli atomların varlığı tespit edilmiştir. Kütle spektrometresi ile izotop atomların bağıl atom kütleleri ve doğada bulunma yüzdeleri ölçülür. Örneğin kütle spektrometresi ile neonun doğada üç izotopu olduğu bulunmuştur.


Mol – Kütle Hesabı

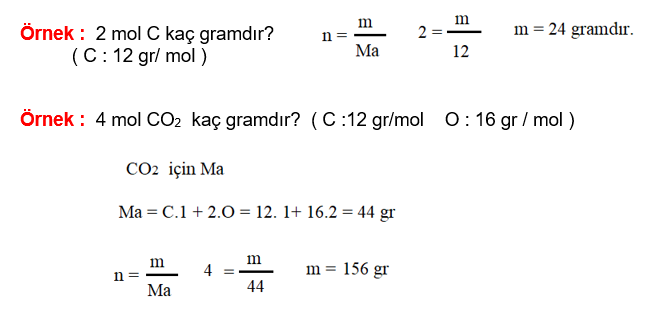
Mol – Tanecik Hesabı
Soruda madde miktarı tane olarak verilmişse mol sayısı aşağıdaki eşitlikle bulunur.

Örnek : 9,2 gram Na elementi kaç tane atom içerir? (Na:23 g/mol)
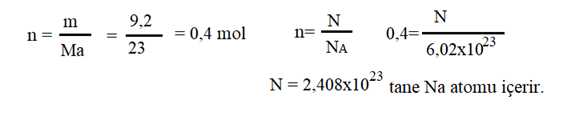
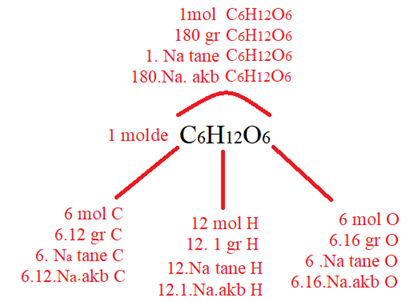
Örnek : 1mol C6H12O6 molekülünün içerdiği atomların sayısı, ağırlığı akb değeri ve molü incelenirse;
Kimyasal tepkimelerde maddenin halleri (fiziksel durumları) k (katı), s (sıvı), g (gaz) gibi simgelerle gösterilir.
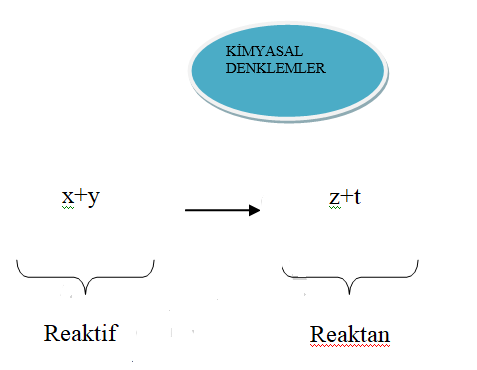
Kimyasal Reaksiyonlar ve Reaksiyon Denklemleri
Denklem; reaksiyona giren (reaktif) ve reaksiyon sonucu oluşan maddelerin ( ürünler) cins ve miktarlarını belirten semboller topluluğudur.
Denklemlerde yer alan maddelerin formüllerinin arkasına o bileşiğin hangi durumda olduğunu belirten işaretler konur,
(k: katı, kristal); (aq: sulu çözelti).
(s: sıvı);
(g: gaz);
(amorf);
Bir kimyasal denklemin aşağıdaki sorulara cevap vermesi gerekir.
Reaksiyon denklemleri elektron alış-verişi olmayan reaksiyonlar ve elektron alışverişi olan reaksiyonlar olmak üzere iki grupta toplanabilir. Elektron alışverişi olan reaksiyonlar yükseltgenme (oksidasyon)-indirgenme (redüksiyon) reaksiyonları veya redoks reaksiyonları olarak adlandırılır. Reaksiyon denklemleri; molekül denklemi ve iyon denklemi olmak üzere iki şekilde yazılabilir.
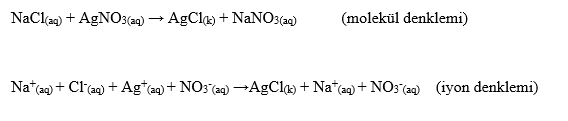
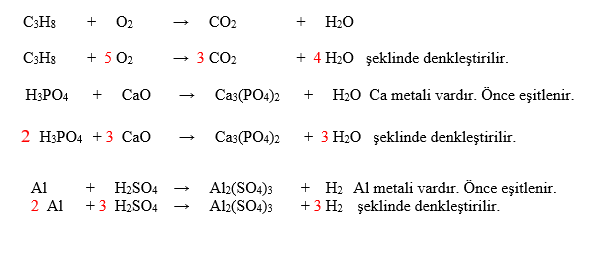
KİMYASAL TEPKİMELERİ DENKLEŞTİRME
Tepkimeler denkleştirilirken önce metaller , sonra ametaller en son hidrojen ve oksijenlerin sayısı eşitlenir. Atom sayısı fazla olan bileşiğe dikkat edilir. Örneğin aşağıdaki ilk tepkimede hiç metal yoktur. En kalabalık molekül C3H8’ dir. Ona göre denkleştirme yapılırsa;