KİMYASAL TEPKİME TÜRLERİ:
EKZOTERMİK TEPKİMELER
Dışarıya ısı veren tepkimelerdir. Ürün kısmına ısı yazılır.
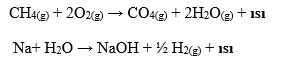
ENDOTERMİK TEPKİMELER
Dışarıdan ısı alınarak gerçekleşen tepkimelerdir. Girenler kısmına yazılır.
2NO + O2 + ısı → 2NO2(g)
Asallık : Maddelerin bulundukları koşullarda ya da hiçbir koşullarda tepkimeye girmemesine ise asallık adı verilir.
Altın -----> HCI , suya -----> asaldır.
CO2; O2 li ortamda yanmaması asaldır.
Yangın söndürücü olarak kullanılır.
Tepkime Türleri
1) Analiz Tepkimeleri
2) Sentez Tepkimleri
3) Yanma Tepkimeleri
4) Çözünme – Çökme Tepkimeleri
5) Asit – Baz Tepkimleri
1. ANALİZ TEPKİMELERİ :
Bir bileşiğin ısı veya elektrik enerjisiyle daha küçük kimyasal türlere ayrışmasına analiz (ayrışma) tepkimesi denir.
Analiz tepkimeleri genel olarak aşağıdaki şekilde ifade edilir.
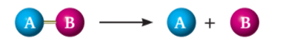
Örnek:
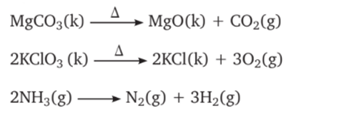
2) SENTEZ TEPKİMELERİ :
İki veya daha fazla kimyasal türün tepkimeye girerek bileşik oluşturmasına sentez (oluşum) tepkimesi denir.
Sentez tepkimesi genel olarak aşağıdaki şekilde ifade edilir.

Örnek :
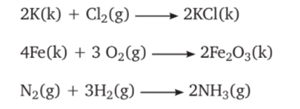
3) YANMA TEPKİMELERİ :

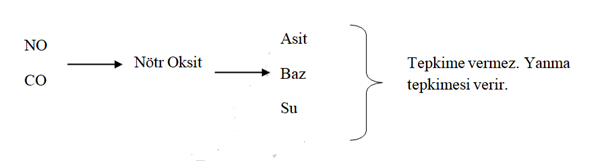
c) Organik maddelerin yanması sonucunda CO2 ve H2O oluşturur (Ekzotermik).
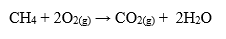
Yanma tepkimeleri= yükseltgenme – indirgenme
Yanma olayının gerçekleşmesi için;
· Yanıcı madde
· Yakıcı madde
· Tutuşma sıcaklığı
Bir maddenin yangın söndürücü olması için;
· Yanıcı-yakıcı olmamalıdır.
· Yoğunluğu havanın yoğunluğundan büyük olmalıdır.
4) ÇÖZÜNME-ÇÖKELME TEPKİMELERİ :
Suda çok iyi çözünebilen tuzlar;

Çökelme tepkimelerine örnek;
- Pamukkale travertenleri
- Mağaralardaki sarkıt-dikitler
- Böbrek taşı (insan kanı (Ca+2 iyonu)+ıspanak okzalik asit → CaC2O4(Kalsiyum Okzalat))
- Salyongoz kabuğu
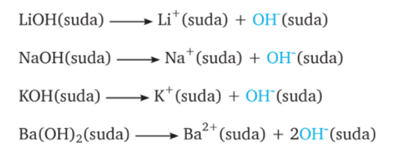
5. ASİT-BAZ TEPKİMELERİ (NÖTRALLEŞME)
ASİTLER
· Tatları ekşidir.
· Sulu çözeltilerinde ortama H+ iyonu verir.
· Sulu çözeltileri elektrik akımını iletir.

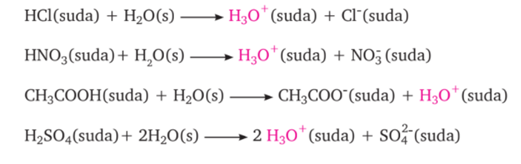
BAZLAR
· Tatları acıdır.
· Ele kayganlık hissi verirler.
· Sulu çözeltileri elektrik akımını iletir.
NaOH (s) → iletmez NaOH (suda) → iletir
En bilinen bazlar ;

Bazlar ortama OH- iyonu verirler.