ASİTLER , BAZLAR VE TUZLAR
Asitlerin Genel Özellikleri
Siyah üzüm → Tartarik Asit
Limon → Sitrik Asit
Elma → Malik Asit
Sirke → Asetik Asit
Portakal Mandalina → Askorbik Asit
Yoğurt → Laktik Asit
Aspirin → Asetil salisilik Asit
Karınca Salgısı→Formik asit
Tereyağı→Bütirik asit
Bazların Genel Özellikleri
Sabun→ C17H35COONa
Deterjan→ C12H25OSO3Na
Çamaşır Suyu→ NaCIO
Çamaşır Sodası→ Na2CO3
Sönmüş Kireç→ Ca (OH)2
Kireç Taşı→ CaCO3
Lavabo Açıcı→ NaOH (sudkostik) KOH (potaskostik)
Yemek Sodası→ NaHCO3
Cam Temizleme Suyu→ NH3
Bozuk Balık, Pis Kokular → (CH3)3N (trimetilamin)
ASİTLER VE BAZLARDA pH ve pOH KAVRAMI
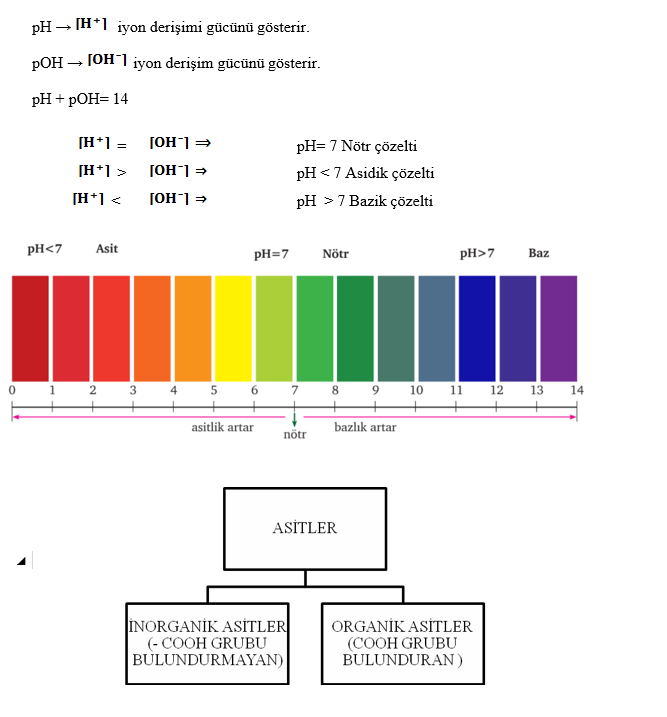
ASİTLERİN KUVVETLİLİĞİ
KUVVETLİ ASİTLER
H2SO4, HNO3, HCI kuvvetli asitlere örnektir.
ZAYIF ASİTLER
CH3COOH , HCOOH, HF ( Cam asidi) ,H2CO3 (Kola asidi)
HCN,HNO2 H3PO4 gibi asitler zayıf asitlere örnektir.
BAZLARIN KUVVETLİLİĞİ
KUVVETLİ BAZLAR
NaOH, KOH, LiOH , Mg(OH)2 kuvvetli bazlara örnektir.
ZAYIF BAZLAR
NH3( Amonyak), C6H5NH2 (Anilin) zayıf bazlara örnektir.
İNORGANİK ASİTLER (SUDA ÇÖZÜNME DENKLEMLERİ)

ORGANİK ASİTLERİN SUDA ÇÖZÜNMELERİ

BAZLAR SUDA ÇÖZÜNME DENKLEMLERİ
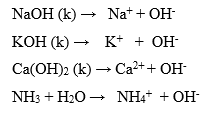
UYARI: Yapısında H+ olmasına rağmen baz karakterli olan moleküller vardır. Formülünde OH- olmasına rağmen asit olan moleküller vardır. Dolayısıyla H+ ve OH- molekülün formülünde olmasına bakılmaz. Suya verdiği iyon olarak H+ ve OH- dikkate alınır.
BAZLARIN TESİR DEĞERLİĞİ: Ortama verdikleri OH- sayısıdır.
