FAZ DİYAGRAMI:
Birbiriyle temasta olan birkaç kısımdan oluşan bir sistemin her bir homojen olan kısmına faz denir. Faz diyagramı ile arı bir maddenin belirli dış basınç ve sıcaklıktaki fiziksel hali belirlenir. Aşağıda saf su ve CO2'nin faz diyagramları verilmiştir.

AB, AC ve AD eğrileri düzlemi üç bölgeye ayırır. Maddenin sıcaklık ve basıncının kesiştiği nokta hangi bölgeye düşerse, madde o fiziksel haldedir.
AB eğrisi : Katı - sıvı denge durumunu belirler. Bu eğri üzerindeki noktalar maddenin çeşitli basınçlardaki donma noktalarını (veya erime noktalarını) gösterir.
AC eğrisi : Sıvı - gaz denge durumunu belirler. Bu eğri üzerindeki noktalar maddenin çeşitli basınçlardaki kaynama noktalarını (veya yoğunlaşma noktalarını) gösterir.
AD eğrisi : Katı - gaz denge durumunu belirler. Bu eğri üzerindeki noktalar maddenin çeşitli basınçlardaki süblimleşme noktalarını (veya kırağılaşma noktalarını) gösterir.
A noktası : Üçlü nokta denir. Maddelerin katı, sıvı ve gaz hallerinin tümünün aynı ortamda bir arada bulunabildiği sıcaklık ve basınç değerine üçlü nokta denir.
Suyun faz diyagramında katı - sıvı eğrisi biraz sola yatıktır. Eğri incelendiğinde dış basınç arttıkça suyun donma noktasının düştüğü görülür. CO2'nin faz diyagramında katı - sıvı eğrisi biraz sağa yatıktır. Eğri incelendiğinde dış basınç arttıkça donma noktasının yükseldiği görülür.
Tüm maddelerin faz diyagramında katı - sıvı eğrisi, sıcaklık eksenine dike yakındır. Bu nedenle basıncın donma noktasına etkisi çok azdır.
JOULE THOMSON OLAYI
Herhangi bir maddeyi soğutmanın yollarından birisi kendisinden daha soğuk başka bir maddenin içine koymaktır. Buz, sıvı hava, kuru buz (katı CO2), aseton - alkol veya aseton - eter karışımı bu amaçla kullanılan soğutucu maddelerdendir. Bu konu hakkında ilk defa çalışan bilim insanları James Prescott Joule ve William Thomson'dur.
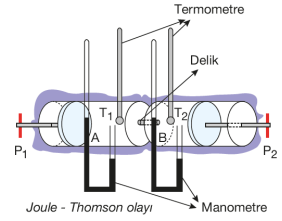
Joule ve Thomson yaptıkları deneyin sonucunda hızla genleştirilen gazların farklı davrandıklarını, bazı gazların sıcaklığında değişiklik olmadığı, bazı gazların ısındığı, bazı gazların ise soğuduğunu gözlemlemişlerdir. Gazlar genleştirildiklerinde, moleküller birbirinden uzaklaşırlar ve bundan dolayı gazların hacimlerinin artmasıyla moleküller birbirinden ayrılarak ortalama hızları düşer. Genişleyen gazın molekülleri arasındaki çekim kuvvetlerinin yenilmesi için gereken enerji dış ortamdan alınamayacağından dolayı gaz moleküllerinin öz ısıları kullanılarak karşılanır. Bu şekilde genleştirilen gazlar hızla soğurlar. Soğuyan gaz bulunduğu ortamı da soğutur. Bu gözleme Joule - Thomson olayı adı verilir. Joule - Thomson olayının uygulamalarına buzdolabı, klima ve derin dondurucuların soğutulması, bisiklet sibobunda soğuma, pompada sıkışan gazın ısınması gibi örnekler verilebilir.
Joule - Thomson olayı sonucunda genleşme sırasındaki sıcaklık değişimi ne kadar küçük ise gaz ideale o kadar yakındır.
Gaz, Buhar ve Kritik Sıcaklık
Bulunduğu sıcaklıkta, hiçbir basınç altında sıvılaştırılamayan sıkıştırılabilir akışkanlara gaz denir. Gazların sıcaklığı arttıkça, sıvılaştırılmaları zorlaşır ve basınç uygulanması gerekir. Ancak gazlar için bazı sıcaklıklar vardır ki, bu sıcaklığın üstünde ne kadar basınç uygulanırsa uygulansın sıvılaştırılamazlar. Her gaz için ayrı olan bu sıcaklığa kritik sıcaklık adı verilir. Kritik sıcaklık, bir gazın basınç uygulanarak sıvılaştırılabileceği en yüksek sıcaklıktır ve TK ile gösterilir. Gazlar gibi davrandıkları halde, bulundukları sıcaklıkta basınçla sıvılaştırılabilen akışkanlara buhar adı verilir. Buhar ile gaz arasında bir dönüşüm yoktur. Buhar özelliğinin ortadan kalkarak gaz özelliğinin başladığı sıcaklık, kritik sıcaklıktır. Buharlaşırken ortamdan ısı alarak bulunduğu ortamın soğumasına sebep olan maddelere soğutucu akışkanlar denir.
Soğutucu akışkan olarak kullanılacak maddenin basınçla sıvılaştırılabilmesi ve üzerindeki basınç kaldırıldığında buhar hale geçmesi gerekmektedir.
Soğutucu akışkanların sahip olması gereken bazı özellikler aşağıda verilmiştir.
GAZ KARIŞIMLARI
Hayatımızın devam etmesi için sürekli solumak zorunda olduğumuz hava, başta azot ve oksijen olmak üzere karbondioksit, argon ve başka gazları içeren bir gaz karışımıdır. Doğal gaz, hava gazı, LPG (sıvılaştırılmış petrol gazı)
Dalton Kısmi Basınçlar Kanunu : Birbiri ile tepkime vermeyen gazlar karıştırıldıklarında homojen olarak aralarındaki boşluklara dağılır. Her gaz kapta sanki diğer gaz yokmuş gibi davranışlarını devam ettirir. Bir gaz karışımında bulunan gazlardan her birinin uyguladığı basınca o gazın kısmi basıncı denir. Bir gazın kısmi basıncı, o gazın, aynı hacimde tek başına bulunduğu zaman yaptığı basınca eşittir. Gazların kısmi basınçlarının toplamı ise karışımın toplam basıncını oluşturur. Bu kurala Dalton Kısmi Basınçlar Kanunu denir. Dalton, bir gaz karışımındaki toplam basıncın, gaz moleküllerinin yapısına değil, gazların toplam mol sayısına bağlı olduğunu ifade etmiştir.
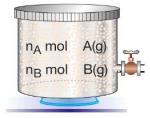
Yandaki kapta bulunan A ve B gazlarının kısmi basınçları sırasıyla PA ve PB'dir. Karışımın toplam basıncı ise PT = PA + PB olur. Gazların mol sayıları nA ve nB ile gösterildiğinde ise karışımın toplam mol sayısı nT = nA + nB olur. Karışımı oluşturan gazların hacimleri ve sıcaklıkları aynı olacağına göre, kısmi basınçları oranı mol sayıları oranına eşittir.
Daha önce öğrendiğimiz P1 / P2 = n1 / n 2 eşitliği gazların kısmi basınçları ve mol sayıları ile karışımın toplam basıncı ve mol sayısına uygulandığında PA/PT = nA / nT ve PB / PT = nB / NT bağıntıları elde edilir.
Mol Kesri : Bir gaz karışımındaki gazlardan birinin mol sayısının, toplam mol sayısına oranına o gazın mol kesri denir ve X ile gösterilir. Örneğin A ve B gazlarından oluşan karışım için XA= nA / nT XB= nB / nT XA + X B = 1 dir. Buna göre; A gazının kısmi Basıncı PA = nA / nT X PT yada PA = XA . PT formülü ile hesaplanır. Bir gaz karışımında gazların mol kesirlerinin toplamı 1'dir.