GAZLARDA KİNETİK TEORİ VE GERÇEK GAZLAR:
Gazların Kinetik Teorisi :
Gazların, katılara ve sıvılara göre farklılık gösteren davranışlarını açıklayabilmek için bir teori geliştirilmiştir. Kinetik teori adı verilen bu teori 19. yüzyılın başlarında Ludwig Boltzman (Ludvig Boltzman), James Clerk Maxwell (Ceyms Klark Maksvel) ve diğer bilim insanlarının çalışmaları ile ortaya konulmuştur. Bu teoriye göre;
Graham Difüzyon Kanunu:
Gaz moleküllerinin kolayca karışabilmelerinin sebebi, molekülleri arasında büyük boşluklar olmasıdır. Gazların birbiri içinde veya boşlukta dağılmalarına yayılma (difüzyon) denir. Birbirleri ile tepkime vermeyen A ve B gazları aynı ortamda karıştırıldığında sıcaklık aynı olacağından moleküllerin ortalama kinetik enerjileri de birbirine eşit olur.
EKA = EKB
→ 1/2 mA. VA2 = 1/2 mB. VB2 → (VA2 / VB2) = mB / m A → ( VA / V B) = √(mB / m A)
Gazların kütleleri yerine molekül kütlelerini yazarsak ( VA / V B) = √(MAB / m AA) eşitliği elde edilir. Elde edilen eşitlik gazların yayılma hızlarının mol kütlelerinin karekökü ile ters olduğunu göstermektedir. Bu eşitlik 1828 - 1833 yıllarında yaptığı deneysel çalışmalar sonucunda, Thomas Graham (Tamıs Gıraham) tarafından bulunmuş ve Graham Difüzyon Kanunu adını almıştır. Aynı şartlarda molekül kütlesi yoğunlukla doğru orantılı olduğundan, molekül kütleleri yerine yoğunluklar kullanılarak
( VA / V B) = √(dB / d A) eşitliği elde edilir. Ayrıca, molekül kütlesi küçük olan molekül daha kısa sürede yayılacağından, moleküllerin hızları yayılma süreleri ile ters orantılıdır.
Mutlak sıcaklık sabitse eğim basınçlar arasındaki ilişkiyi verir. Eğimi büyük olanın basıncı küçüktür. P1 > P2
( VA / V B) = √(MB / m A) = √(dB / d A) = ( tB / tA) ( tA,tB → A ve B gazlarının yayılma süresidir.)
Herhangi bir X gazı için moleküllerinin kinetik enerjisi;
EK = (1/2).m.V2 iken (m: kütle , V:gaz moleküllerinin hızı) ortalama kinetik enerjisi ise;
EK = (3/2).k.T (k: sabit bir sayı, T:mutlak sıcaklık)
formülü ile ifade edilmektedir. Bu iki kinetik enerji ifadesi eşitlendiğinde (1/2).m.V2 = (3/2).k.T , eşitliği elde edilir. Bir gazın sıcaklığıyla hızı arasındaki bağıntı ise (m ve k aynı olduğundan)
(V12 / V22 ) = (T1 / T2 ) →( V1 / V2 ) = √(T1 / T 2) şeklinde bulunur.
Gazların yayılma hızları, mutlak sıcaklığın karekökü ile doğru orantılıdır. Sıcaklıkları aynı olan gazların ortalama kinetik enerjileri de aynıdır.
Sabit basınçta kapalı bir kaptaki gazın küçük bir delikten, kabın iç basıncı dış basıncına eşit olana kadar, dışarıya doğru yayılmasına efüzyon (dışarı yayılma) denir. Difüzyon ve efüzyon ikisi de aynı anlama gelmektedir. Aralarındaki fark efüzyonda gaz küçük bir delikten kaçarak yayılır. Difüzyon için kullanılan ifadeler efüzyon için de geçerlidir. Ortalama hız gazın molekül ağırlığına da bağlıdır. V2 α 1/MA Buna göre molekül ağırlığı küçük olan gazın ortalama hızı (difüzyon hızı) büyük olur.
O2: 32, He : 4, CH4 : 16
VHe = 2 . V CH4VHe = 2 √2 . VO2
VCH4 = √2 . VO2 olur.
Gazların Sıkışma ve Genleşme Özelliği
Gazların sıkıştırılabilmeleri fiziksel bir özelliktir. Sıkıştırma ile gazlar birbirlerine daha çok yaklaşırlar ve aralarındaki uzaklık azalır. Böylece sıkıştırma maddenin fiziksel halinin değişmesine sebep olabilir. Gazlar sıcaklıkları azaltılıp basınçları arttırıldığında sıvılaşma özelliği kazanmaktadır. Sıvılaştırılmış gazlar ise hayatımızın çeşitli alanlarında kullanılmaktadır.
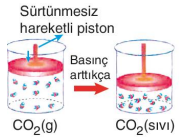
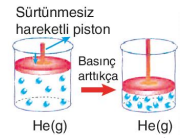
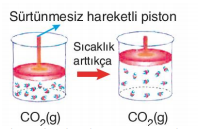
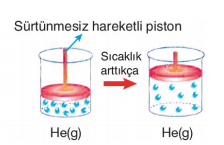
Kaplar içindeki CO2 ve He gazları basınçla sürtünmesiz piston sayesinde sıkıştırılmaktadır. Basınç arttıkça CO2 ve He gazlarının molekülleri arasındaki uzaklık azalır. Bunun sonucunda CO2 gazı, moleküller arasındaki çekim kuvvetinin artmasıyla sıvılaşır. Ama uygulanan basınç He'un sıvılaşmasını sağlayamaz. Bu durumda CO2 gazını gerçek gaz, He gazını ise ideale yakın gaz olarak nitelendirebiliriz. Moleküller arası etkileşimi olan ve moleküllerin birbirinden etkilendiği gazlara gerçek gazlar denir. Molekülleri arasındaki etkileşimlerin sonucunda gerçek gazlar basınçla sıvılaşabilir. Gerçek gazlarda moleküllerin hacmi ihmal edilemez. Molekülleri arasında etkileşim (çekim kuvveti) olmayan, moleküllerinin davranışları birbirinden etkilenmeyen ve moleküllerinin hacmi çok küçük olduğundan toplam hacim yanında ihmal edilebilen gazlara ideal gaz denir. Doğada bulunan gazların hiçbiri ideal gaz değildir. Ancak gerçek gazlar yüksek sıcaklık ve düşük basınçta idealliğe yaklaşır.
Yukarıdaki şekillerde de görüldüğü gibi CO2 ve He gazlarının sıcaklığı arttıkça, moleküllerin ortalama kinetik enerjileri artar ve daha hızlı hareket etmeye başlarlar. Kabın çeperlerine çarpma sayıları da artar. Çarpma sonucunda oluşan itme kuvvetlerinin etkisiyle sürtünmesiz piston yukarı doğru hareket eder. Kabın hacmi de artmış olur. Sıcaklığın artmasıyla gaz moleküllerinin hareketliliğinden kaynaklanan hacim değişimine ısıl genleşme adı verilir. CO2 gazındaki ısıl genleşme, He gazındaki ısıl genleşmeden daha az olmuştur. Bunun sebebi He gazının ideale daha yakın olmasıdır.
İdeal gazlarda;
İdeal Gaz Durumundan Sapmalar
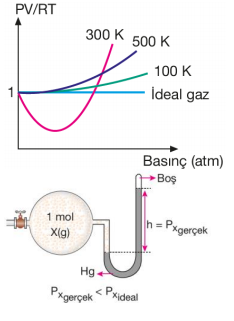
Genellikle gerçek gazlar her koşulda PV = nRT formülüne tam olarak uyamazlar. 1 mol ideal gaz için PV = nRT eşitliği uygulandığında PV/RT = 1 olur. Yandaki grafik değişik sıcaklıklarda CH4 gazının PV/RT oranının basınçla değişimini göstermektedir. İdeal gazlar için PV/RT oranı her sıcaklık ve basınçta 1'dir.