GAZLARIN SU ÜZERİNDE TOPLANMASI :
Dalton'un kısmi basınç kanununun diğer bir uygulaması, bir kaptaki su üstünde toplanan ve suda çözünmeyen bir gazın basıncının hesaplanmasıdır. Bir kapta su üstünde bir gaz toplandığında ölçülen basınç, sadece gazın basıncı değildir. Bu basınç, gaz fazında bulunan su buharının basıncı ile gazın kısmi basıncının toplamıdır.
PT = Pgaz + Psu buharı
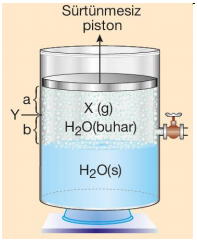
Sıvısı ile dengede bulunan buharın sıvı yüzeyine yaptığı basınca denge buhar basıncı denir. Suyun buhar basıncı sıcaklığa bağlıyken suyun miktarına, bulunduğu kabın hacmine ve şekline bağlı değildir. Gazın su üzerinde toplanabilmesi için suda çözünmemesi ve suyla tepkime vermemesi gerekir. Şekildeki kapta bir miktar saf su ve suyun üzerinde suda çözünmeyen X gazı varken;
PT = PX + PH2O olur. Sabit sıcaklıkta piston Y noktasına itilirse
Buhar molekülleri sayısı azalır → Buhar molekülleri sayısı azalır → Suyun buhar basıncı değişmez.
X gazının kısmi basıncı artar → Birim hacimdeki buhar molekülleri sayısı değişmez → Toplam basınç 2 katına çıkmaz.
Bağıl Nem: Havanın su buharı içeriği genellikle bağıl nem terimi ile ifade edilir. Bağıl nem, su buharı kısmi basıncının, aynı sıcaklıkta suyun buhar basıncına oranıdır ve yüzde ile verilir. Yani belli bir sıcaklıkta havadaki buharlaşma ve yoğunlaşma dengesine denir. Örneğin, bağıl nem %100 ise su, buharı ile dengede demektir. Bağıl nem %100 den küçük bir değerdeyse buharlaşma, büyük bir değerdeyse yoğunlaşma gerçekleşir. Bağıl nem en fazla ülkemizde Karadeniz Bölgesi'nde görülmektedir.
Örneğin, 25°C'ta havadaki su buharının kısmi basıncı 12,2 mm Hg, suyun buhar basıncı 23,8 mm Hg ise;
Bağıl nem = ( Su buharının kısmi basıncı / Suyun buhar basıncı ) * 100
Bağıl nem =12,2 /23,8 x 100= % 51,3
Bağıl nem %100'den küçük olduğu için buharlaşma olur.
TEPKİME VERMEYEN GAZLARIN KARIŞTIRILMASI
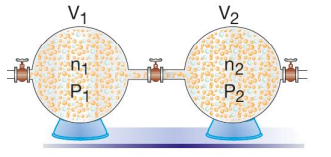
Yukarıda verilen farklı kaplardaki aynı veya birbiri ile tepkime vermeyen farklı gazlar aynı sıcaklıkta karıştırıldığında gazların mol sayılarında bir değişiklik olmayacağından toplam mol sayısı nT = n1 + n2 olur. İdeal gaz denkleminden de n = P . V / R . T olduğundan
( (PT . VT) / RT ) = ( (P1 . V1) / RT ) + ( (P2 . V2) / RT ) → (1/ RT). (PT . VT) = (P1 . V1 + P2 . V2) . 1 / RT
PT . VT = P1 . V1 + P2 . V2 olur. Bu eşitliğe de Birleşik Gaz Denklemi denir.
İçerilerinde aynı veya farklı gazların bulunduğu kaplar, musluk yardımıyla birbirine bağlanmışsa bu tür kaplara bileşik kaplar adı verilir. Bileşik kaplarda musluk açıldığında gazların hacmi kapların hacimleri toplamıdır.
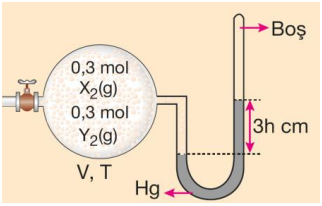
Sisteme sabit sıcaklıkta X gazı ile tepkime vermeyen Y gazı eklendiğinde;
TEPKİME VEREN GAZLARIN KARIŞTIRILMASI
Kimyasal tepkime sırasında, molce birleşmeler gereği, tepkimeye girenlerle ürünlerin toplam mol sayıları arasında fark varsa, tepkime sabit sıcaklıkta ve sabit hacimde oluşsa bile, tepkime sırasında basınç değişir. Basınç sabit tutulursa hacim değişir.