
GAZ KARIŞIMLARI Hayatımızın devam etmesi için sürekli solumak zorunda olduğumuz hava, başta azot ve oksijen olmak üzere karbondioksit, argon ve başka gazları içeren bir gaz karışımıdır. Doğal gaz, hava gazı, LPG (sıvılaştırılmış petrol gazı)

Dalton Kısmi Basınçlar Kanunu: Birbiri ile tepkime vermeyen gazlar karıştırıldıklarında homojen olarak aralarındaki boşluklara dağılır. Her gaz kapta sanki diğer gaz yokmuş gibi davranışlarını devam ettirir. Bir gaz karışımında bulunan gazlardan her birinin uyguladığı basınca o gazın kısmi basıncı denir. Bir gazın kısmi basıncı, o gazın, aynı hacimde tek başına bulunduğu zaman yaptığı basınca eşittir. Gazların kısmi basınçlarının toplamı ise karışımın toplam basıncını oluşturur. Bu kurala Dalton Kısmi Basınçlar Kanunu denir. Dalton, bir gaz karışımındaki toplam basıncın, gaz moleküllerinin yapısına değil, gazların toplam mol sayısına bağlı olduğunu ifade etmiştir.
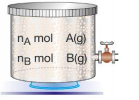
Yandaki kapta bulunan A ve B gazlarının kısmi basınçları sırasıyla PA ve PB'dir. Karışımın toplam basıncı ise PT = PA + PB olur. Gazların mol sayıları nA ve nB ile gösterildiğinde ise karışımın toplam mol sayısı nT = n A + nB olur. Karışımı oluşturan gazların hacimleri ve sıcaklıkları aynı olacağına göre, kısmi basınçları oranı mol sayıları oranına eşittir.

Mol Kesri

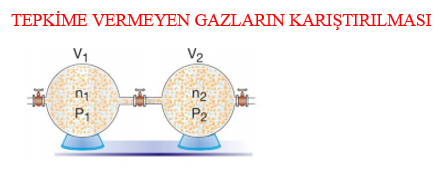
Yukarıda verilen farklı kaplardaki aynı veya birbiri ile tepkime vermeyen farklı gazlar aynı sıcaklıkta karıştırıldığında gazların mol sayılarında bir değişiklik olmayacağından toplam mol sayısı nT = n1 + n2 olur. İdeal gaz denkleminden de n = P . V / R . T olduğundan
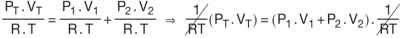
PT . VT = P1 . V1 + P2 . V2 olur. Bu eşitliğe de Birleşik Gaz Denklemi denir.
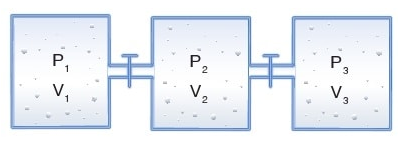
İçerilerinde aynı veya farklı gazların bulunduğu kaplar, musluk yardımıyla birbirine bağlanmışsa bu tür kaplara bileşik kaplar adı verilir. Bileşik kaplarda musluk açıldığında gazların hacmi kapların hacimleri toplamıdır.
Buna göre, musluk açılırsa P1, V1 birinci kaptaki gazın mol sayısını, P2, V2 ikinci kaptaki gazın mol sayısını, P3, V3 üçüncü kaptaki gazın mol sayısını, Pson, Vtopise son durumdaki toplam mol sayısını gösterir.
İdeal gaz denklemi ilk durumlar için ve son durum için eşitlenecek şekilde yazılır. Zira ideal gaz için her durumda geçerlidir.
Birleşik kap sisteminde musluklar açılıp yeterince beklendiğinde her bir gazın yeni hacmi sistemin hacmine eşit olur. Basınç ise kabın her noktasında eşittir. Sisteme sabit sıcaklıkta X gazı ile tepkime vermeyen Y gazı eklendiğinde;

GAZLARIN SU ÜZERİNDE TOPLANMASI Dalton'un kısmi basınç kanununun diğer bir uygulaması, bir kaptaki su üstünde toplanan ve suda çözünmeyen bir gazın basıncının hesaplanmasıdır. Bir kapta su üstünde bir gaz toplandığında ölçülen basınç, sadece gazın basıncı değildir. Bu basınç, gaz fazında bulunan su buharının basıncı ile gazın kısmi basıncının toplamıdır.
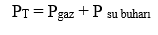
Sıvısı ile dengede bulunan buharın sıvı yüzeyine yaptığı basınca denge buhar basıncı denir. Suyun buhar basıncı sıcaklığa bağlıyken suyun miktarına, bulunduğu kabın hacmine ve şekline bağlı değildir. Gazın su üzerinde toplanabilmesi için suda çözünmemesi ve suyla tepkime vermemesi gerekir. Şekildeki kapta bir miktar saf su ve suyun üzerinde suda çözünmeyen X gazı varken;

Bağıl Nem: Havanın su buharı içeriği genellikle bağıl nem terimi ile ifade edilir. Bağıl nem, su buharı kısmi basıncının, aynı sıcaklıkta suyun buhar basıncına oranıdır ve yüzde ile verilir. Yani belli bir sıcaklıkta havadaki buharlaşma ve yoğunlaşma dengesine denir. Örneğin, bağıl nem %100 ise su, buharı ile dengede demektir. Bağıl nem %100 den küçük bir değerdeyse buharlaşma, büyük bir değerdeyse yoğunlaşma gerçekleşir. Bağıl nem en fazla ülkemizde Karadeniz Bölgesi'nde görülmektedir.
