Organik Bileşiklerin Lewis Yapısı Hibritleşme
Farklı enerjideki atom orbitallerinin enerjilerni yeniden düzenleyecek yeni orbitalleroluşturmasına hibritleşme (melezleşme) denir. Hibritleşme sonucu oluşan yeni orbitallere de hibrit orbitalleri denir. Hibritleşme, enerji düzeyleri yakın olan orbitaller arasında olur. s ile p arasında sp, sp2 ve sp3 hibritleşmesi olmak üzere üç hibritleşme mevcuttur.
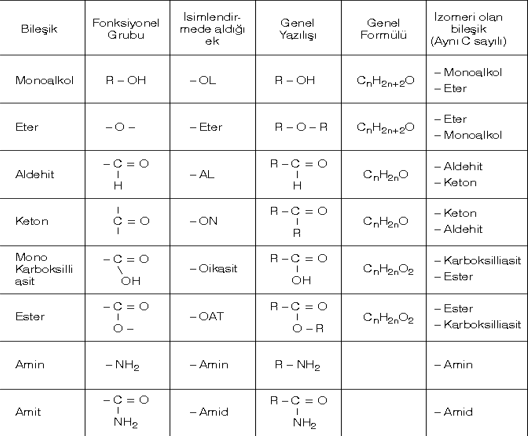
Bileşiklerin Lewis formülü yazılırken işlem basamakları esas alınırsa kolaylık sağlanmış olur.
1. Moleküldeki toplam değerlik elektron sayısı bulunur.
2. Moleküldeki her atomun dublet, ya da oktetini tamamlaması için gerekli elektron sayısı bulunur ve toplanır.
3. 2. adımda bulunan toplam elektron sayısı ikiye bölünerek moleküldeki bağ sayısı bulunur.
4. Bağlar atomlar arasına yerleştirilir. Bağ yapmayan elektronlar atomların çevresine okteti sağlanacak şekilde dağıtılır.
Hibritleşme:
Farklı enerjideki atom orbitallerinin enerjilerni yeniden düzenleyecek yeni orbitalleroluşturmasına hibritleşme (melezleşme) denir. Hibritleşme sonucu oluşan yeni orbitallere de hibrit orbitalleri denir.
Hibritleşme, enerji düzeyleri yakın olan orbitaller arasında olur. s ile p arasında sp, sp2 ve sp3 hibritleşmesi olmak üzere üç hibritleşme mevcuttur.
Merkez Atomun Hibrit Türünü Bulma
Sadece tek bağ oluşturan karbon atomu sp3 hibritleşmesi yapar.
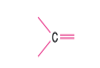
İkili bağ oluşturan karbon sp2 hibritleşmesi yapar (p orb. biri hib. katılmaz).
Üçlü bağ oluşturan karbon atomu sp hib. yapar. (p orb. ikisi hib. katılmaz).
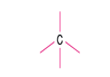
C atomu sp3 hibritleşmesi yapar.
(4 doğrultu)
C atomu sp3 hibritleşmesi yapar.
(4 doğrultu)
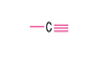
C atomu sp hibritleşmesi yapar.
(2 doğrultu)
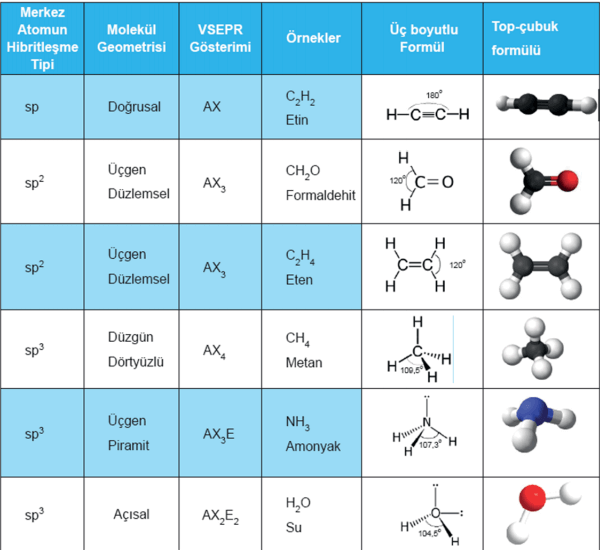
Molekül Geometrisi
Merkez atomun ve merkez atoma bağlı diğer atomların üç boyutlu ortamda uzanımları sonucunda oluşan şekle molekül geometrisi denir.
Molekül geometrisi, değerlik kabuğu elektron çifti itme kuramına (VSPER) göre belirlenir.
Molekül geometrisi belirlenirken, hibrit orbitallerinin özdeş olması ve üç boyutlu mekanda birbirinden olabildiğince uzak durması (aradaki açının en büyük olması) ilkesinden yararlanılır.
A, merkez atomunu; E, elektron çiftini; X, bağlı bir atomu göstermek üzere bazı moleküllerin molekül geometrisi, merkez atomun hibritleşme türü ve bağ açısı tabloda verilmiştir.