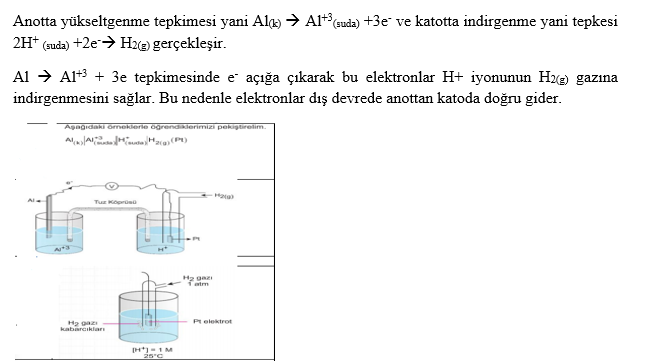
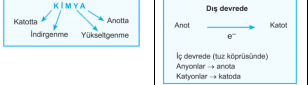
İndirgenme-Yükseltgenme (Redoks)
Bir tepkime sırasında bir maddeden diğer bir maddeye elektron transferi oluyorsa, bu tür tepkimelere indirgenme -yükseltgenme tepkimeleri ya da kısaca "redoks tepkimeleri" denir.
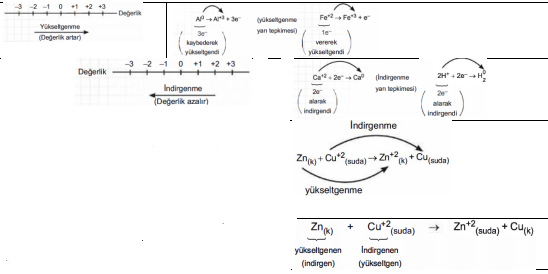
Yükseltgenme: Bir atom ya da iyonun elektron vermesi olayına yükseltgenme denir. Elektron kaybının olduğu yarı tepkimeye de yükseltgenme yarı tepkimesi denir. Yükseltgenme sırasında atom ya da iyonun değerliği verilen elektron sayısı kadar artar.
İndirgenme: Bir atom ya da iyonun elektron alması olayına indirgenme denir. Elektron alındığını gösteren yarı tepkimeye de indirgenme yarı tepkimesi denir. Elektron vererek değerliği artan maddeye yükseltgenen, elektron alarak değerliği azalan maddeye de indirgenen madde denir. Bir madde yükseltgenmeden diğeri indirgenemeyeceği için yükseltgenen madde aynı zamanda indirgen ya da indirgeyen maddedir. Benzer mantıkla indirgenen madde de aynı zamanda yükseltgen ya da yükseltgeyendir. Sonuç olarak, yükseltgenmeye uğrayan madde, birlikte tepkimeye girdiği maddeyi indirgediği için indirgen, indirgenmeye uğrayan madde birlikte tepkimeye girdiği maddeyi yükseltgediği için yükseltgen olarak adlandırılır. Bu tepkimede Zn atomu 2 elektron vererek değerliği 2 artmıştır (yükseltgenen madde); Cu+2 iyonu ise bu 2 elektronu alarak değerliği azalmıştır (indirgenen madde). Cu+2 ye elektron vererek onun indirgenmesini sağladığı için Zn bir indirgen; Cu+2 de elektronları alarak Zn nin yükseltgenmesini sağladığı için yükseltgendir.
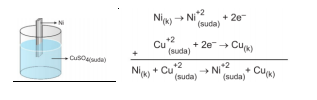
Aktiflik Metallerin elektron verme, ametallerin ise elektron alma istekleri aktiflik olarak tanımlanır. Element halinde bulunan bir metal, bileşik halindeki bir metali açığa çıkarıyorsa yani onunla yer değiştiriyorsa, bu metal diğerinden aktiftir. Bu olay sırasında aktif metal aşınır. Örnek olarak; Ni metalini CuS04 çözeltisine daldırırsak, Ni metali çözünür, Cu metali açığa çıkar.

Aşağıdaki tepkimeler kendiliğinden oluşmaktadır.
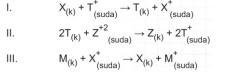
Buna göre X, T, Z ve M metallerinin elektron verme (aktiflik) eğilimine göre sıralanışı büyükten küçüğe doğru nasıl olur?
Çözüm: Tepkimelere tek tek bakarsak I. tepkimede elektron verip T+ nın indirgenmesi sağlayan X metali olduğundan X daha aktiftir, (X > T). II. tepkimede T metali elektron vererek Z*2 yi indirgediğinden T metali Z'den daha aktiftir, (T > Z). III. tepkimede M metali elektron vererek X* iyonunu indirgediğinden, M metali X den daha aktiftir, (M > X). Buna göre elektron verme eğilimleri yani aktiflik M > X > T > Z şeklinde sıralanır.
Aktif metalden yapılmış bir kaba daha pasif bir metal iyonunu içeren bir çözelti konulursa, aktif metal elektron vererek aşınır ve bu kapta çözelti saklanamaz.
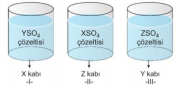
X, Y ve Z metallerinin elektron verme eğilimleri X > Y > Z şeklindedir. Buna göre, yukarıdaki kaplardan hangilerinde bir süre sonra aşınma olur? Çözüm: Metallerin elektron verme eğilimleri X > Y > Z şeklinde olduğundan, I. kapta X° + Y+2SO4à X +2SO4 + Y° şeklinde bir tepkime gerçekleşir. Çünkü X, Y den daha aktif olduğundan X, 2 elektron vererek (+2) iyonuna; Y+2 iyonu da 2 elektronu alarak Y katısına dönüşür. Buna göre tepkime olan bu kapta aşınma gözlenir ve X kabında YSO4 çözeltisi saklanamaz.
II. kapta Z° + X+2 SO4à tepkimesi gerçekleşmez. Çünkü X, Z’den daha aktif bir metaldir ve elektron verip (+) yüklü olmak ister. Zaten, X çözeltisinde (+2) yüklü olduğundan bu kapta aşınma olmaz ve bu kapta XSO4 çözeltisi saklanabilir.
III. kapta Y° + Z+2SO4à Y +2SO4 + Z° şeklinde bir tepkime olur. Y metali Z’den daha aktif olduğundan, Y metali 2 elektron vererek (+2) yüke sahip olurken, Z+2 iyonları da 2 elektron alarak indirgenir. Y kabı aşınır ve bu kapta ZSO4 çözeltisi saklanamaz.
Elektrokimyasal Piller: Elektrokimyasal piller, kendiliğinden gerçekleşen redoks tepkimeleriyle elektrik enerjisi üreten sistemlerdir. Galvanik ya da Volta pilleri olarak da adlandırılırlar.
Anyon: (-) yüklü iyonlardır. Katyon: (+) yüklü iyonlardır.
Elektrot: Yükseltgenme ya da indirgenmenin gerçekleştiği tel ya da levha halinde olan metal parçasıdır.
Elektrolit: Elektrotun içine daldırıldığı sıvıdır.
Anot: Yükseltgenmenin gerçekleştiği elektrottur.
Katot: İndirgenmenin gerçekleştiği elektrottur.
Standart Yarı Piller: Eğer bir yarı pil, 25 °C ve 1 atm basınç altında 1 M lık iyon çözeltisine daldırılmış bir metal elektrot içeriyorsa, bu tür yarı pillere standart yarı pil denir.
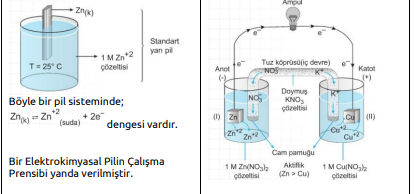
a. Eğer iki yarı pilin elektrotları, küçük bir ampulden geçen metal bir iletken ile birleştirilirse, yarı pillerdeki denge bozulmuş olur.
b. Elektrotları birbirine bağlayan devreye dış devre denir. Zn metali Cu metalinden daha aktif olduğundan, tepkimeleri gerçekleşir. Çinko ve bakır elektrot ve bunların çözeltilerinin kullanıldığı pile aynı zamanda Daniell pili de denir.
c. Yükseltgenme anotta gerçekleşir.
d. İndirgenme katotta gerçekleşir.
e. Anotta elektronlar üretildiği için anot (-) yüklüdür. f. Katot ise (+) yüklüdür. Dış devrede elektronlar anottan katoda doğru hareket ederler (- den + ya)
g. Yalnızca dış devre ile pil çalışmaz, devrenin tamamlanması gerekir. Bu nedenle tuz köprüsü kullanılır.
h. Tuz köprüsü elektriksel nötrallığı sağlayarak devreyi tamamlar ve pilin çalışmasını sağlar.
i. Pil çalışırken, anotta Zn katısının kütlesi azalır, Zn iyon derişimi artar. Görüldüğü gibi anotta (+) yük yoğunluğu artacağından nötralliği sağlamak için tuz köprüsündeki (-) yüklü iyonlar (anyonlar) anot bölümüne geçer.
j. Katotta Cu+2 iyonları elektronları alarak indirgendiklerinden II nolu kapta Cu kütlesi artar. Cu+2 derişimi azalır. Nötralliği sağlamak için tuz köprüsündeki (+) yüklü iyonlar (katyonlar) katoda geçerler.
k. Tuz köprüsündeki anyonlar -» anoda, katyonlar àkatoda geçerler.
l. Tuz köprüsündeki bu iyon hareketleri iç devre olarak adlandırılır. Anot tepkimesi solda gösterilir. Katot tepkimesi sağda gösterilir. Tuz köprüsü || işareti ile gösterilir. Kısaca özetlerse
Yukarıda gösterimi verilen pili çizerek anot ve katot bölümlerini ve buralarda gerçekleşen tepkimeleri yazınız. Dış devreden geçen elektron yönünü gösteriniz. Pili çizmeden önce gösterimden sol tarafın anot sağ tarafın katot olduğunu hatırlayalım.