KİMYA VE ELEKTRİK
Madde - Elektrik İlişkisi
(-) yüklü iyonlara anyon, (+) yüklü iyonlara katyon adı verilir.
NaCl(k) + su → Na(suda) + Cl(suda) şeklinde (+) ve (-) iyonlarına ayrışır.
Bu tepkimede Na+ katyon, Cl- anyondur.
1. Bir elementin doğadaki kararlı halinde değerliği (ister atomik, isterse molekül halinde olsun) sıfırdır. Örneğin, H2, O2, N2, F2, Cl2, Br2, l2, P4, S8, He, Sıfır.Ar, Na
2. Tek atomlu bir iyonun değerliği o iyonunun yüküne eşittir. Örneğin,Al+3 → +3, Na+1 → +1, Cl-1 → -1
3. Bir bileşikte, atomların değerlikleri toplamı sıfırdır. Bu sayede bileşik içinde değerliği bilinmeyen elementin değerliği bulunabilir.
4. Çok atomlu (poliatomik) iyonlarda, atomların değerlikleri toplamı, iyonun yüküne eşittir. Örneğin; SO4 -2 iyonunda oksijenin değerliği (-2) dir. 4 tane oksijen atomundan -8 yük gelir. Toplam yük -2 olduğundan x + (-8) = -2 den S nin yükü +6 olur.
5.Periyodik cetvelin 1A grubunda yer alan alkali metaller bileşiklerinde +1, IIA grubunda yer alan toprak alkali metaller bileşiklerinde +2, IIIA grubunda yer alan aluminyum metali +3 değerlik alır.
6.Geçiş metallerinden olan Zn +2, Ag ise +1 değerlik alır.
7.Elektronegatifliği en büyük olan F nin bileşiklerindeki değerliği her zaman (-1) dir.
8.Hidrojenin alkali ve toprak alkali metallerle yaptığı hidrür bileşiklerinde değerliği (-1) dir; bunun dışındaki bileşiklerinde değerliği +1 dir.
9.Oksijen birçok bileşiğinde (-2) değerliklidir, ancak F ile (+2) değerlik alır. OF2-1 → O (+2). Peroksitlerde (O2 -2 her bir oksijen atomunun değerliği (-1) dir.
İndirgenme-Yükseltgenme (Redoks)
Bir tepkime sırasında bir maddeden diğer bir maddeye elektron transferi oluyorsa, bu tür tepkimelere indirgenme -yükseltgenme tepkimeleri ya da kısaca "redoks tepkimeleri" denir.
Yükseltgenme:
Bir atom ya da iyonun elektron vermesi olayına yükseltgenme denir. Elektron kaybının olduğu yarı tepkimeye de yükseltgenme yarı tepkimesi denir.
Yükseltgenme sırasında atom ya da iyonun değerliği verilen elektron sayısı kadar artar.

İndirgenme:
Bir atom ya da iyonun elektron alması olayına indirgenme denir. Elektron alındığını gösteren yarı tepkimeye de indirgenme yarı tepkimesi denir.
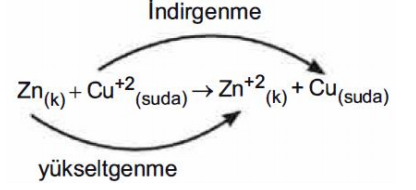
Elektron vererek değerliği artan maddeye yükseltgenen, elektron alarak değerliği azalan maddeye de indirgenen madde denir.
Bir madde yükseltgenmeden diğeri indirgenemeyeceği için yükseltgenen madde aynı zamanda indirgen ya da indirgeyen maddedir. Benzer mantıkla indirgenen madde de aynı zamanda yükseltgen ya da yükseltgeyendir.
Sonuç olarak, yükseltgenmeye uğrayan madde, birlikte tepkimeye girdiği maddeyi indirgediği için indirgen, indirgenmeye uğrayan madde birlikte tepkimeye girdiği maddeyi yükseltgediği için yükseltgen olarak adlandırılır. Bu tepkimede Zn atomu 2 elektron vererek değerliği 2 artmıştır (yükseltgenen madde); Cu+2 iyonu ise bu 2 elektronu alarak değerliği azalmıştır (indirgenen madde). Cu+2 ye elektron vererek onun indirgenmesini sağladığı için Zn bir indirgen; Cu+2 de elektronları alarak Zn nin yükseltgenmesini sağladığı için yükseltgendir.


Aktiflik Metallerin elektron verme, ametallerin ise elektron alma istekleri aktiflik olarak tanımlanır. Element halinde bulunan bir metal, bileşik halindeki bir metali açığa çıkarıyorsa yani onunla yer değiştiriyorsa, bu metal diğerinden aktiftir. Bu olay sırasında aktif metal aşınır. Örnek olarak; Ni metalini CuSO4 çözeltisine daldırırsak, Ni metali çözünür, Cu metali açığa çıkar.
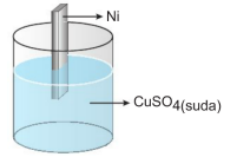
Ni(k) → Ni(suda)+2 + 2e-
Cu(suda)+2 + 2e- → Cu(k)
+
Ni(k) → Ni(suda)+2 + 2e- Bu verilen elektronlar da çözeltide bulunan Cu+2 iyonları tarafından alınıp, Cu katısı oluşmuştur.
Cu(suda)+2 + 2e → Cu(k) Buna göre, net tepkime denklemi yandaki gibi olur. Bu deneyde metallerin yerleri değiştirilmiş olsaydı tepkime olmazdı.
Cu(k) + NiSO4(suda) → Tepkime olmaz. (Buna göre, Cu atomlarından elektronlar Ni+2 iyonlarına geçemez).
Sonuç; 1. Ni metalinin aktifliği (e- verme isteği) Cu metalinden fazladır. 2. Cu+2 iyonlarının indirgenme isteği (e- alma), Ni+2 iyonlarınkinden fazladır. Aktif bir metal, elektron vererek bileşik yapısında bulunan pasif metal iyonunu indirger ve bu metal iyonu ile yer değiştirir.
Aşağıdaki tepkimeler kendiliğinden oluşmaktadır.
Buna göre X, T, Z ve M metallerinin elektron verme (aktiflik) eğilimine göre sıralanışı büyükten küçüğe doğru nasıl olur?
Çözüm: Tepkimelere tek tek bakarsak I. tepkimede elektron verip T+ nın indirgenmesi sağlayan X metali olduğundan X daha aktiftir, (X > T). II. tepkimede T metali elektron vererek Z*2 yi indirgediğinden T metali Z'den daha aktiftir, (T > Z). III. tepkimede M metali elektron vererek X* iyonunu indirgediğinden, M metali X den daha aktiftir, (M > X). Buna göre elektron verme eğilimleri yani aktiflik M > X > T > Z şeklinde sıralanır.
Aktif metalden yapılmış bir kaba daha pasif bir metal iyonunu içeren bir çözelti konulursa, aktif metal elektron vererek aşınır ve bu kapta çözelti saklanamaz.
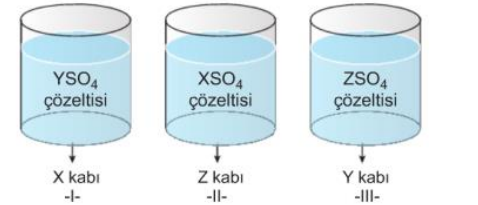
X, Y ve Z metallerinin elektron verme eğilimleri X > Y > Z şeklindedir. Buna göre, yukarıdaki kaplardan hangilerinde bir süre sonra aşınma olur? Çözüm: Metallerin elektron verme eğilimleri X > Y > Z şeklinde olduğundan, I. kapta X° + Y+2SO4 → X +2SO4 + Y° şeklinde bir tepkime gerçekleşir. Çünkü X, Y den daha aktif olduğundan X, 2 elektron vererek (+2) iyonuna; Y+2 iyonu da 2 elektronu alarak Y katısına dönüşür. Buna göre tepkime olan bu kapta aşınma gözlenir ve X kabında YSO4 çözeltisi saklanamaz.