
Bir pilin voltajı ya da gerilimi, iki yan pil tepkimesinin elektron verme eğilimleri arasındaki farktır. Bir pilin gerilimi basınç, sıcaklık ve çözeltilerin derişimlerine bağlıdır. Pil gerilimleri 25 °C ve 1 atm basınçta, iyon derişimi 1 Moları çözeltiler kullanılarak ölçülürse, bu gerilimlere standart o pil gerilimleri denir ve E0 pil şeklinde gösterilir. Tek bir yarı pilin gerilimini ölçmek imkansızdır. Bu nedenle seçilen bir yarı pilin standart gerilimi sıfır kabul edilir (referans elektrot) ve diğer yarı pil gerilimleri bu referansla karşılaştırılarak bulunabilir. Bu işlem için seçilen referans yarı pil standart hidrojen elektrotudur. Tepkimeye girmeyen Pt elektrot (katalizör görevi yapar), 1 M H+ derişimine sahip bir asit çözeltisine 25 °C de batırılır, bu çözelti sürekli olarak 1 atm basınçta H2 gazı ile temas halinde tutulur. Buna göre;
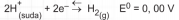
denge olayı olur.
Bu tepkimede H+ iyonunun indirgenme eğilimi ölçülmüş tür. E nin üzerindeki " 0 " standart koşullan belirtir.
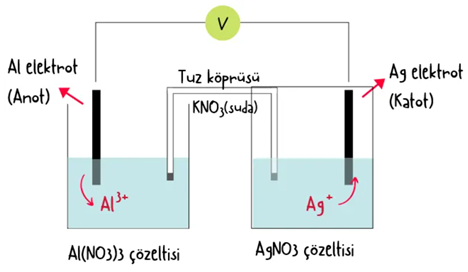
Elektrokimyasal Pil İki yarı hücrenin iletken bir tel ve tuz köprüsü yardımıyla birbirine bağlanmasıyla oluşturulan sisteme elektrokimyasal pil (galvanik hücre) denir. Bu tür pillerde istemli redoks tepkimesi gerçekleşir ve sistem elektrik enerjisi üretir.
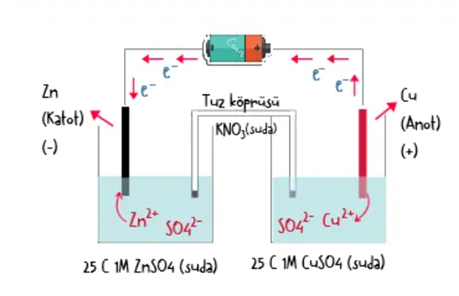
Yukarıda gösterilen düzenekte içerisinde Zn elektrodu ve ZnSO4çözeltisi bulunan anot yarı hücresiyle Cu elektrodu ve CuSO4 çözeltisi bulunan katot yarı hücresinin iletken tel ve tuz köprüsüyle birleştirilmesiyle oluşturulmuş bir elektrokimyasal pil görülmektedir.
Anot yarı hücresinde Zn katısı elektron verip yükseltgenir ve
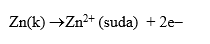
tepkimesi gerçekleşir. Zn elektrodun yükseltgenmesiyle açığa çıkan elektronlar iletken tel yardımıyla dış devreden katot yarı hücresine taşınır. Zn elektrodun kütlesi zamanla azalır ve çözeltideki Zn2+ derişimi artar.
Katot yarı hücresinde çözeltide bulunan Cu2+ iyonları Zn elektrodun verdiği elektronları alarak indirgenir ve
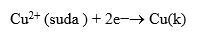
tepkimesi gerçekleşir.
Bu nedenle çözeltideki Cu2+ derişimi zamanla azalır, indirgenen Cu2+ iyonları Cu elektrodun üzerinde toplanır ve elektrodun kütlesi artar. Anot yarı hücresinde pozitif yük miktarı zamanla artarken katot yarı hücresinde pozitif yük miktarı azalır. Yük denkliğinin sağlanması için tuz köprüsündeki NO3- iyonları anot yarı hücresine, K+ iyonları katot yarı hücresine geçer.



Derişim Etkisi
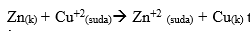
tepkimesinin standart şartlarda E0 pil değeri 1,1 Volttur. İki tür arasındaki elektron alma ve verme eğilimleri arttıkça bu türlerin oluşturdukları pilin gerilimi (Epil) de artar. Yukarıdaki pil sisteminde başlangıçta elde edilen 1,1 V değeri zamanla azalır, çünkü redoks tepkimesi zamanla dengeye ulaşır. Pil tepkimesi dengeye ulaştığında pil potansiyeli sıfır olur ve pil çalışmaz.
Epil = 0 olduğunda sistem dengededir ve pil çalışmaz. ,
Standart pil potansiyelleri 25°C deki çözeltiler için 1 M derişim ve gazlar için 1 atm basınç değeriyle hesaplanırken, ortam koşulları değiştiğinde elektrot potansiyelleri Le Chatelier ilkesine göre hesaplanır. Le Chatelier ilkesine göre tepkimeye girenlerin derişiminin arttırılması tepkimeyi ürünler yönüne, ürünlerin derişiminin arttırılması da tepkimeyi girenler yönüne kaydırır.
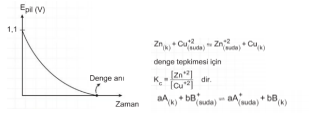
Buna göre, boşalmış bir pili yeniden çalıştırabilmek için [Cu+2] derişimi artırılmalı ve [Zn+2] azaltılmalıdır. Bu etki Le Chatelier ilkesine göre dengeyi sağa kaydırır. Dengeyi sağa kaydıran etkiler pil potansiyelini artırır. Bir redoks tepkimesinin 25°C deki farklı derişimlerdeki pil potansiyeli (Epil) ile standart koşullardaki pil potansiyeli arasındaki ilişki Alman termodinamikçi W. Nernst tarafından bulunmuştur. Nernst denklemine göre
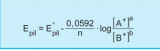
standart koşullarda olmayan pilin potansiyeli hesaplanabilir. (n: Yarı hücre tepkimesinde alınan ya da verilen elektron sayısı) Sıcaklık Etkisi: Pil tepkimeleri dışarıya enerji verdiklerinden ekzotermiktir. Buna göre; Sıcaklık artırılırsa, denge sola kayar, pil gerilimi azalır.
Basınç Etkisi: Basıncın pil gerilimine etkisi ancak gaz elektrotlarda gözlenir. Pilinde H2 basıncının artırılması, dengenin sola kaymasını sağlar ve böylelikle pil gerilimi azalır.
Elektrot Yüzey Alanı Etkisi: Elektrotların yüzey alanını değiştirmek, pil gerilimini etkilemez.
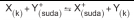
denge tepkimesinde Le Chatelier ilkesine göre
•X(k) miktarının artırılması dengeyi etkilemez. • [Y+ ] derişiminin artması dengeyi sağa kaydırır.
• [X+ ] derişiminin artması dengeyi sola kaydırır.
• Y(k) miktarının artırılması dengeyi etkilemez.
• Pil tepkimeleri her zaman ekzotermik olduğundan sıcaklık arttırılırsa denge sola kayar.

Epil : 25°C de farklı derişimdeki pil gerilimi
E 0pil : 25°C de standart koşullardaki pil gerilimi pil
Kc : derişime bağlı denge sabiti
n: yarı hücre tepkimesindeki alınan ya da verilen elektron sayısı.
Derişim Pilleri Elektrotları aynı, elektrolit derişimleri farklı olan elektrokimyasal pillere derişim pili denir.
• Bu pillerde elektrolit derişimi küçük olan yarı hücre anot, büyük olan yarı hücre katot görevindedir.
• Derişim pillerinde zamanla anot yarı hücresinin derişimi artar, katot yarı hücresinin derişimi azalır.
• Bir derişim pilinde anot ve katot yarı hücrelerinin derişimleri eşitlenince pil potansiyeli sıfır olur, pil çalışmaz.
Suyun Elektrolizi
Saf suyun 1 atm basınç ve 25°C sıcaklık koşullarında H2(g) ve 02(g) şeklinde bileşenlerine ayrılması kendiliğinden gerçekleşmez, istemsizdir.
Suyun elektrolizi işleminde Hoffman voltametresi kullanılır. Saf suyun elektrolizi çok yavaş gerçekleştiğinden, tepkimeyi hızlandırmak için H2SO4, NaOH gibi iyon oluşturarak elektrik iletkenliğini artıran, ancak değişime uğramayan çözeltiler kullanılabilir. Saf suyun elektrolizinde anot ve katotta gerçekleşen tepkimeler aşağıdaki gibidir.
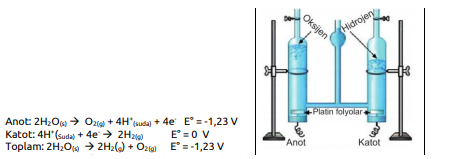
Görüldüğü gibi saf suyun elektrolizi sonucunda elde edilen hidrojen ve oksijen gazlarının hacimleri birbirine eşit değildir. Görüldüğü gibi saf suyun elektrolizi sonucunda elde edilen hidrojen ve oksijen gazlarının hacimleri birbirine eşit değildir.

Sulu Çözeltilerin Elektrolizi Sulu çözeltilere elektroliz uygulandığı zaman ortamda tuzdan gelen iyonların yanı sıra çözücü olan suda yükseltgenme ve indirgenme de yer alır. Genel olarak ortamda bulunan maddelerden indirgenme gerilimi yüksek olan katotta, yükseltgenme gerilimi büyük olan madde ise anotta açığa çıkar. Sulu NaCI çözeltisini ele alırsak
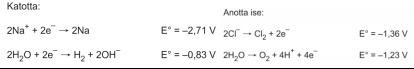
tepkimelerinin gerçekleşmesi olasıdır.
Yükseltgenme ve indirgenme gerilimlerine bakarsak katotta, H2 gazı ve anotta O2 gazı açığa çıkması gerekir. Ancak endüstriyel uygulamalarda anotta O2 yerine genelde Cl2 gazı açığa çıkar. Bunun birkaç nedeni vardır. Genellikle çözeltiler derişik olduğundan Cliyon derişimi fazla olur. Ayrıca endüstriyel uygulamalarda elektrot direncinin önüne geçmek için yüksek voltaj uygulanır. O halde Naci'nin sulu çözeltisinde katotta H2 elde edilirken anotta Cl2 açığa çıkar. Elektroliz sırasında maddelerin yükseltgenme ve indirgenme gerilimleri verilmediği zaman, aşağıda verilen kurallara göre anot ve katot tepkimeleri belirlenir :
1. Anot ve katotta pasif element önce açığa çıkar. (Aktiflik metallerde e- verme, ametallerde ise e- almalıdır.)
2. Poliatomik iyonlar (NO3- , SO4-2, PO4-3 ) yükseltgenmezler. Bunların yerine O2 gazı oluşur.
3. F - iyonu hiç bir zaman yükseltgenmez. Onun yerine O2 gazı oluşur.
4. Sulu çözeltilerde I- , Br- , Cl- iyonları varsa öncelikle bunlar açığa çıkar.
5. Aktif metaller açığa çıkmazlar. Soy metaller varsa H2 den önce bunlar açığa çıkar, örneğin, Cu, Ag gibi metaller varken Na, K gibi metaller indirgenmezler.